
【题目】(1)按要求写出下列反应的离子方程式
①人体胃液中有胃酸(0.2%~0.4%的盐酸),起杀菌、帮助消化等作用,但胃酸的量不能过多或过少,它必须控制在一定范围内,当胃酸过多时,医生通常用胃舒平【氢氧化铝】给病人治疗。该反应的离子方程式为___________________;
②实验室用碳酸钙与盐酸反应制取CO2气体,反应的离子方程式___________________;常用澄清石灰水检验CO2气体的离子方程式是___________________;
③表面附有铁锈(成分是Fe2O3)的铁钉放入稀硫酸中,开始反应的离子方程式是___________________;反应片刻后,可观察到有气体产生,其离子方程式是___________________;
(2)按要求将化学方程式改为离子方程式
2Na2O2 +2H2O =4NaOH +O2↑___________________;
(3)写出离子反应方程式CO2+2OH-=CO32-+H2O所对应的一个化学方程式___________________;
(4)有一瓶无色澄清溶液,其中可能含有H+、Na+、Mg2+、Ba2+、Cl-、SO42-、CO32-离子。现进行以下实验:
A、用PH试纸检验溶液,发现溶液呈强酸性;
B、取部分溶液逐滴加入NaOH溶液,使溶液由酸性变为碱性,无沉淀产生;
C、取少量B中的碱性溶液,滴加Na2CO3溶液,有白色沉淀产生。
①根据上述事实确定:该溶液中肯定存在的离子有 ;肯定不存在的离子有 ;
可能存在的离子有 。
②写出C中发生反应的离子方程式 。
【答案】(1)① Al(OH)3+3H+=Al3++3H2O
②CaCO3+2H+=Ca2++H2O +CO2↑
Ca2++2OH-+CO2=CaCO3↓+H2O
③Fe2O3+6H+=2Fe3++3H2O
Fe +2H+=Fe2++H2↑
(2)2Na2O2+2H2O=4Na++ 4OH-+O2↑
(3)CO2+2NaOH=Na2CO3+H2O
(4)① H+ Ba2+ Cl- CO32- Mg2+ SO42- Na+
②Ba2++ CO32-=BaCO3↓
【解析】
试题分析:(1)①盐酸与氢氧化铝反应生成氯化铝和水,该反应为3HCl+Al(OH)3= AlCl3+3H2O,氢氧化铝沉淀和水写化学式,离子反应为Al(OH)3+3H+=Al3++3H2O。②碳酸钙与盐酸反应可生成氯化钙、二氧化碳和水,反应的离子方程式为:CaCO3+2H+=Ca2++H2O +CO2↑。③二氧化碳与澄清的石灰水反应可生成碳酸钙沉淀和水,反应的离子方程式为:Ca2++2OH-+CO2= CaCO3↓+H2O。
(2)过氧化钠、水是氧化物,不能拆,氧气是气体,不能拆,氢氧化钠是强碱,可拆,故该反应的离子方程式为:2Na2O2+2H2O=4Na++ 4OH-+O2↑。
(3)由离子反应方程式CO2+2OH-= CO32-+H2O可知,该反应为二氧化碳与可溶性强碱溶液反应生成可溶性碳酸盐和水的反应,故对应的一个化学方程式为:CO2+2NaOH=Na2CO3+H2O。
(4)①由“无色澄清溶液”得,原溶液没有相互反应的离子;由实验①的现象判断,排除与强酸反应的CO32-离子存在。原溶液呈强酸性,所以阴离子可能是Cl-或SO42-;由实验②的现象判断,排除与NaOH反应的Mg2+存在;根据实验③现象判断,原溶液中含有Ba2+,不含与Ba2+反应的![]() 所以原溶液中存在的阴离子是Cl-,通过以上现象不能判断原溶液中是否含有Na+。通过以上分析,该溶液中肯定存在的离子有H+、Ba2+、Cl-;肯定不存在的离子有
所以原溶液中存在的阴离子是Cl-,通过以上现象不能判断原溶液中是否含有Na+。通过以上分析,该溶液中肯定存在的离子有H+、Ba2+、Cl-;肯定不存在的离子有![]() Mg2+
Mg2+ ![]() , 可能存在的离子有Na+。
, 可能存在的离子有Na+。
②由上述推断可知,C中发生反应为钡离子与硫酸根离子的反应,离子方程式为:Ba2++![]()
![]() BaCO3↓。
BaCO3↓。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】工业上利用锌焙砂(主要含ZnO、ZnFe2O4,还含有少量FeO、CuO等杂质)制取金属锌的工艺流程如下:
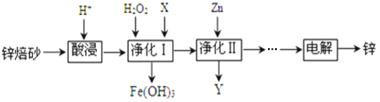
回答下列问题:
(1)ZnFe2O4是一种性能优良的软磁材料,也是一种催化剂,能催化烯类有机物氧化脱氢等反应。
① ZnFe2O4中Fe的化合价是___________,从物质分类角度说,ZnFe2O4属于__________(填“酸”、“碱”或“盐”)。
② 工业上利用反应ZnFe2(C2O4)3·6H2O![]() ZnFe2O4+2CO2↑+4CO↑+6H2O制备ZnFe2O4。该反应中氧化产物是______________(填化学式),每生成1mol ZnFe2O4,转移电子的物质的量是___________。
ZnFe2O4+2CO2↑+4CO↑+6H2O制备ZnFe2O4。该反应中氧化产物是______________(填化学式),每生成1mol ZnFe2O4,转移电子的物质的量是___________。
(2)酸浸时要将锌焙砂粉碎,其目的是提高酸浸效率。为达到这一目的,还可采用的措施是___________(任答一条);已知ZnFe2O4能溶于酸,则酸浸后溶液中存在的金属离子有______________。
(3)净化Ⅰ中H2O2参与反应的离子方程式为_______________;试剂X的作用是___________。
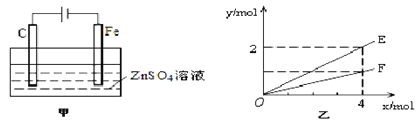
(4)钢铁镀锌是钢铁防护的一种有效方法。按图甲装置进行模拟铁上镀锌的实验,实验结果如图乙所示。乙中横坐标x表示电路中通过电子的物质的量,纵坐标y表示反应物或生成物的物质的量。
① C电极的电极反应式为________________________。
② E可以表示的量是_________________________(任写一种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述错误的是( )
A.10mL质量分数为98%的H2SO4,用10mL水稀释后,H2SO4的质量分数大于49%
B.配制0.1mol/L的Na2CO3溶液480mL,需用500mL容量瓶
C.在标况下,将22.4L氨气溶于1 L水中,得到1mol/L的氨水
D.向两等份不饱和的烧碱溶液中分别加入一定量的Na2O2和Na2O,使溶液均恰好饱和,则加入的Na2O2与Na2O的物质的量之比等于1:1(保持温度不变)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若两容器的温度和压强均相同,且甲的密度大于乙的密度,则下列说法正确的是( )
A. 甲的分子数比乙的分子数多
B. 甲的物质的量比乙的物质的量小
C. 甲的气体摩尔体积比乙的气体摩尔体积小
D. 甲的相对分子质量比乙的相对分子质量小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关金属及其化合物的说法正确的是
A.铝和氢氧化钠溶液反应生成Al(OH)3和H2O
B.钠在空气中燃烧生成淡黄色的Na2O
C.铁在高温下与水蒸气反应生成Fe2O3和H2
D.用碳酸钠和氢氧化钙反应制NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由氧化铜、氧化铁组成的混合物a g,加入2mol·L-1的硫酸50mL时固体恰好完全溶解。若将a g该混合物在足量的一氧化碳中加热充分反应,冷却后固体质量为
A.1.6g B.(a-1.6)g C.(a -3.2)g D.无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)氯酸是一种强酸,氯酸的浓度超过40%就会迅速分解,反应的化学方程式为:8HClO3=3O2↑+2Cl2↑+4HClO4+2H2O。根据题意完成下列小题:
①在上述变化过程中,发生还原反应的过程是______________→______________(填化学式)。
②该反应的氧化产物是____________(填化学式);求所得混合气体的平均相对分子质量。
(2)已知测定锰的一种方法是:锰离子转化为高锰酸根离子,反应体系中有H+、Mn2+、H2O、IO![]() 、MnO
、MnO![]() 、IO
、IO![]() 。
。
①有关反应的离子方程式为__________________。
②在锰离子转化为高锰酸根离子的反应中,如果把反应后的溶液稀释到1 L,测得溶液的pH=2,求在反应中转移电子的物质的量 mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知分子式为C10H14的有机物,该有机物不能与溴水发生加成反应,分子中只有一个烷基,符合要求的有机物结构有( )
A. 2种 B. 3种 C. 4种 D. 5种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com