
��֪һ���¶��£����������ܵ���ʵ��ܽ�ƽ�����ݣ�
| ���� | Fe��OH��2 | Cu��OH��2 | Fe��OH��3 |
| Ksp/25 �� | 8.0��10��16 | 2.2��10��20 | 4.0��10��38 |
| ��ȫ����ʱ��pH��Χ | ��9.6 | ��6.4 | 3��4 |
 ��Ǭ����������ҵ���ּ����ӱ����������ϵ�д�
��Ǭ����������ҵ���ּ����ӱ����������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
ij�¶��£�pH��ͬ��������Ȼ����Һ�ֱ�ϡ�ͣ�pH����Һ����仯����������ͼ��ʾ����ͼ�ж����������У���ȷ����
| A����Ϊ�Ȼ��ϡ��ʱpHֵ�仯���ߣ���Ϊ����ϡ��ʱpHֵ�仯���� |
| B��b����Һ��ˮ�ĵ���̶ȱ�d����Һ��ˮ�ĵ���̶ȴ������KW��ͬ |
| C��a��ʱ�������������Һ�ֱ���NaOH��Ӧ�����ĵ�NaOH����ͬ |
| D��c����Һ�ĵ�������һ����b����Һ��������ǿ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
ʵ�飺��0��1mol��L��1AgNO3��Һ��0��1mol��L��1NaCl��Һ�������ϵõ���Һa�����˵õ�
��Һb�Ͱ�ɫ����c��������Һb�еμ�0��1mol��L��1KI��Һ�����ֻ��ǣ��������c�еμ�0��1mol��L��1KI��Һ��������Ϊ��ɫ�����з�������ȷ����:
A����Һa�д��ڳ����ܽ�ƽ�⣺AgCl(g) 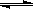 Ag+(aq)+Cl-(aq) Ag+(aq)+Cl-(aq) |
| B����Һb�в�����Ag+ |
| C��������ɫ�仯˵��AgClת��ΪAgI |
| D��ʵ�����֤��AgI��AgCl������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
����������ȷ����
| A�����ʵ���Ũ����ȵ�CH3COOH��CH3COONa��Һ�������ϣ�2c(Na+) + c(CH3COOH) = c(CH3COO��) +2c(OH��) |
| B��Ksp(AgCl)>Ksp(AgI)�ɴ˿����ж�AgCl(S) + I- = AgI(S) + Cl-�ܹ����� |
| C����ˮ�У�c(Cl��)��c(H+)��c(OH��)��c(ClO��) |
| D���к�Ũ�����������ȵ�����ʹ�����Һ������NaOH�����ʵ�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
�±���3�����ʵ��ܽ��(20 ��),����˵������ȷ����(�� ��)
| ���� | MgCl2 | Mg(OH)2 | MgCO3 |
| �ܽ��(g/100 g) | 74 | 0.000 84 | 0.01 |
 ),��c(Mg2+)��c(C
),��c(Mg2+)��c(C )=6.82��10-6
)=6.82��10-6 ��Ӳˮ,���������ӷ�Ӧ����ʽΪMg2++2HC
��Ӳˮ,���������ӷ�Ӧ����ʽΪMg2++2HC +Ca2++2OH-
+Ca2++2OH- CaCO3��+MgCO3��+2H2O
CaCO3��+MgCO3��+2H2O�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
50 ��ʱ�����и���Һ�У����ӵ����ʵ���Ũ�ȹ�ϵ��ȷ����(����)��
| A��pH��4�Ĵ����У�c(H��)��4.0 mol��L��1 |
| B������С�մ���Һ�У�c(Na��)��c(HCO3��) |
| C������ʳ��ˮ�У�c(Na��)��c(H��)��c(Cl��)��c(OH��) |
| D��pH��12�Ĵ�����Һ�У�c(OH��)��1.0��10��2 mol��L��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
�����й�����Ũ�ȹ�ϵ����������ȷ���� (����)��
| A��25 ��ʱ��NaB��Һ��pH��8��c(Na��)��c(B��)��9.9��10��7mol��L��1 |
| B��25 ��ʱ����0.1 mol��L��1NH4HSO4��Һ�еμ�NaOH��Һ�����ԣ�c(Na��)>c(NH4+)>c(SO42��)>c(OH��)��c(H��) |
| C��0.1 mol��L��1NaHCO3��Һ�У�c(OH��)��2c(CO32��)��c(H��)��c(H2CO3) |
| D��ͬ���£�pH��ͬʱ����Һ���ʵ���Ũ�ȣ�c(CH3COONa)>c(NaHCO3)>c(C6H5ONa)>c(Na2CO3) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
�����£���10 mL 0.1 mol��L��1 Na2CO3��Һ����μ���0.1 mol��L��1 HCl��Һ����Һ��pH���ͣ���ʱ��Һ�к�̼�������ʵ��������仯��ͼ��ʾ(CO2���ݳ�δ�����������������ݳ��������Һ����仯)������˵����ȷ���� (����)��
| A����0.1 mol��L��1 Na2CO3��Һ�У�c(Na��)��c(H��)��c(CO32��)��c(HCO3��)�� c(OH��) |
| B������Һ��pHΪ7ʱ����Һ�������Ϊ20 mL |
| C����B����ʾ����Һ�У�Ũ��������������Na�� |
| D����A����ʾ����Һ�У�c(CO32��)��c(HCO3��)>c(H��)>c(OH��) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
25 ��ʱ,ˮ�ĵ���ﵽƽ��:H2O H++OH-,������������ȷ����(����)
H++OH-,������������ȷ����(����)
| A������ˮ���ȵ�95 ��ʱ,KW���,pH����,ˮ�Գ����� |
| B����ˮ�м���ϡ��ˮ,ƽ�������ƶ�,c(OH-)����,KW��С |
| C����ˮ�м�����������̼����,c(H+)��С,KW����,Ӱ��ˮ�ĵ���ƽ�� |
| D����ˮ�м�������ƻ�����,��������ˮ�ĵ���,KW���� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com