
【题目】某小组取一定质量的FeSO4固体,利用下图装置进行实验.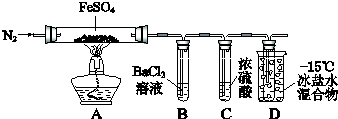
实验过程 | 实验现象 | |
① | 通入一段时间N2 , 加热 | A中固体变为红棕色,B中有白色沉淀,D试管中有无色液体 |
② | 用带有火星的木条靠近装置D的导管口 | 木条复燃 |
③ | 充分反应,停止加热,冷却后,取A中固体,加盐酸 | 固体溶解,溶液呈黄色 |
④ | 将③所得溶液滴入D试管中 | 溶液变为浅绿色 |
已知:SO2 熔点﹣72℃,沸点﹣10℃;SO3熔点16.8℃,沸点44.8℃.
(1)实验③反应的离子方程式是 .
(2)分解过程除产生使木条复燃的气体外,仅由A中固体颜色变化推测,还一定有气体,依据是 .
(3)实验④反应的离子方程式是 .
(4)某同学依据B中的现象,认为FeSO4分解一定有SO3生成.你认为是否正确,原因是(用必要的文字和化学方程式解释)
【答案】
(1)Fe2O3+6H+=2Fe3++3H2O
(2)SO2;因为有Fe2O3生成,在FeSO4中只有+6价S元素有氧化性,能被还原.因此一定有SO2生成
(3)2Fe3++SO2+2H2O=2Fe2++SO42﹣+4H+
(4)不正确,因为分解有O2和SO2生成,在水溶液中发生反应:2SO2+O2+2H2O=2H2SO4 , 故无论分解反应是否有SO3生成,都会有此现象,2SO2+O2+2H2O+2BaCl2=2BaSO4↓+4HCl.
【解析】解:(1)根据②木条复燃说明有氧气生成,根据A中固体变为红棕色,说明A中固体变为红棕色为氧化铁,B中有白色沉淀为硫酸钡,是因为硫酸亚铁在氮气的条件下隔绝空气加热分解生成氧化铁、二氧化硫,所以实验③反应的离子方程式是Fe2O3+6H+=2Fe3++3H2O,故答案为:Fe2O3+6H+=2Fe3++3H2O;(2)根据氧化还原反应的特点,元素化合价升高的价数等于元素化合价降低的价数,分解过程除产生使木条复燃的气体为氧气说明氧元素的化合价在升高,A中固体变为红棕色为氧化铁,因为有Fe2O3生成,铁的化合价也在升高,在FeSO4中只有+6价S元素有氧化性,能被还原,因此一定有SO2生成,故答案为:SO2;因为有Fe2O3生成,在FeSO4中只有+6价S元素有氧化性,能被还原.因此一定有SO2生成;(3)取A中固体,加盐酸Fe2O3+6HCl=2FeCl3+3H2O,将③所得溶液滴入D试管中,溶液变为浅绿色说明有二价铁生成,说明三价铁离子被还原,D试管中有无色液体为二氧化硫,发生的反应为2Fe3++SO2+2H2O=2Fe2++SO42﹣+4H+ , 故答案为:2Fe3++SO2+2H2O=2Fe2++SO42﹣+4H+;(4)因为硫酸亚铁在氮气的条件下隔绝空气加热分解一定生成氧化铁、二氧化硫,不一定有三氧化硫,B中的现象是有白色沉淀生成,白色沉淀为硫酸钡,该沉淀可能是2SO2+O2+2H2O=2H2SO4 , H2SO4+BaCl2=BaSO4↓+2HCl,故无论分解反应是否有SO3 生成,都会有此现象,总反应为2SO2+O2+2H2O+2BaCl2=2BaSO4↓+4HCl,故答案为:不正确,因为分解有O2 和SO2 生成,在水溶液中发生反应:2SO2+O2+2H2O=2H2SO4 , 故无论分解反应是否有SO3 生成,都会有此现象;2SO2+O2+2H2O+2BaCl2=2BaSO4↓+4HCl.(1)A中固体变为红棕色为氧化铁;然后加盐酸,是氧化铁和盐酸反应,据此书写离子反应方程式;(2)分解过程除产生使木条复燃的气体为氧气,A中固体变为红棕色为氧化铁,因为有Fe2O3生成,在FeSO4中只有+6价S元素有氧化性,能被还原,因此一定有SO2生成;(3)A为氧化铁加盐酸生成三价铁离子,将③所得溶液滴入D试管中,溶液变为浅绿色说明有二价铁生成,所以三价铁离子和二氧化硫发生了氧化还原反应,据此解答;(4)FeSO4分解不一定有SO3生成,B中的现象是有白色沉淀生成,可能是在水溶液中发生反应:2SO2+O2+2H2O=2H2SO4 , H2SO4+BaCl2=BaSO4↓+2HCl,故无论分解反应是否有SO3 生成,都会有此现象,据此解答.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.铅蓄电池放电时铅电极发生还原反应
B.电解饱和食盐水在阳极得到氯气,阴极得到金属钠
C.给铁钉镀铜可采用CuSO4作电镀液
D.生铁浸泡在食盐水中发生析氢腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是 ( )
A. 氯气是黄绿色的,C1—是无色的
B. H2在C12中能安静燃烧,火焰呈苍白色,瓶口有白色烟雾生成
C. Cl2和H2的混合气一定会发生爆炸
D. 燃烧时一定要有氧气参加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应MnO2+4HCl(浓)==MnCl2+Cl2↑+2H2O,_____元素化合价降低,_______电子,发生_______反应,被_________;氧化剂是_____________,氧化产物是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有25℃时0.1mol/L的氨水.请回答以下问题:
(1)若向氨水中加入少量硫酸铵固体,此时溶液中 ![]() (填“增大”、“减小”或“不变”);
(填“增大”、“减小”或“不变”);
(2)若向氨水中加入稀硫酸,使其恰好中和,写出反应的离子方程式;所得溶液的pH7(填“>”、“<”或“=”),用离子方程式表示其原因;
(3)若向氨水中加入稀硫酸至溶液的pH=7,此时c(NH4+)=amol/l,则c(SO ![]() )=;
)=;
(4)若向氨水中加入pH=1的硫酸,且氨水与硫酸的体积比为1:1,则所得溶液中各离子物质的量浓度由大到小的关系是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用二氧化氯(ClO2)、铁酸钠(Na2FeO4摩尔质量为166g/mol)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术.ClO2和Na2FeO4在水处理过程中分别被还原为Cl﹣和Fe3+ .
(1)如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么,ClO2、Na2FeO4、Cl2三种消毒杀菌剂的消毒效率由大到小的顺序是>> .
(2)Na2FeO4溶于水会放出一种无色无味气体,其杀菌消毒、吸附水中的悬浮杂质的原理可用离子方程式表示为 .
(3)工业以CH3OH与NaClO3为原料在酸性条件下制取ClO2 , 同时产生CO2气体,已知该反应分为两步进行,第一步为2ClO3﹣+2Cl﹣+4H+=2ClO2↑+Cl2↑+2H2O.①写出第二步反应的离子方程式 .
②工业生产时需在反应物中加少量Cl﹣ , 其作用是 .
③生产中会发生副反应ClO3﹣+Cl﹣+H+﹣Cl2↑+H2O(未配平),若测得反应后的混合气体中Cl2的体积分数为3/73,则起始投料时CH3OH与NaClO3的物质的量之比为 .
(4)已知二氧化氯是一种黄绿色有刺激性气味的气体,其熔点为﹣59℃,沸点为11.0℃,易溶于水.ClO2也可以看做是亚氯酸(HClO2)和氯酸(HClO3)的混合酸酐.工业上用稍潮湿的KClO3和草酸在60℃时反应制得.某学生用如图所示的装置模拟工业制取及收集ClO2 , 其中A为ClO2的发生装置,B为ClO2的凝集装置,C为尾气吸收装置.请问:①A部分还应添加温度控制(如水浴加热)装置,B部分还应补充什么装置;
②C中应装的试剂为 . C中发生反应的化学方程式为: . 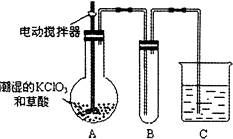
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com