
 甲醇被称21世纪的新型燃料,工业上通过下列反应(Ⅰ)和(Ⅱ),用CH4和H2O为原料来制备甲醇.
甲醇被称21世纪的新型燃料,工业上通过下列反应(Ⅰ)和(Ⅱ),用CH4和H2O为原料来制备甲醇.| [CO][H2]3 |
| [CH4][H2O] |
| [CO][H2]3 |
| [CH4][H2O] |
| [CO][H2]3 |
| [CH4][H2O] |
| 转化量 |
| 起始量 |
| 0.4mol |
| n0 |
| [CH3OH] |
| [CO][H2]2 |


 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:

| 溶液 | 加入物质 |
| (1)饱和石灰水 | 通过量CO2气体 |
| (2)氯化铝溶液 | 加入过量氨水 |
| (3)MgCl2、AlCl3的混合液 | 逐滴加入NaOH溶液至过量 |
| (4)含少量NaOH的NaAlO2溶液 | 逐滴加入稀盐酸 |
| A、②④③① | B、①②③④ |
| C、②③①④ | D、③④②① |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
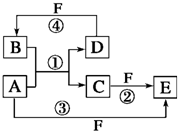 A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出).
A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出).查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 四种有机物
四种有机物查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH4+、NO3-、K+、SO42- |
| B、Ca2+、NO3-、HCO3-、Na+ |
| C、Na+、K+、SO42-、AlO2- |
| D、MnO4-、K+、Na+、SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com