
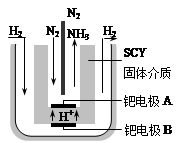
 2NH3(g) ЁїH ЃН-184.4 kJЁЄmol-1 (2Зж)
2NH3(g) ЁїH ЃН-184.4 kJЁЄmol-1 (2Зж) 2NH3(g) ЁїH ЃН-184.4 kJЁЄmol-1ЃЛ
2NH3(g) ЁїH ЃН-184.4 kJЁЄmol-1ЃЛ 2NH3(g)
2NH3(g) 2NH3(g)
2NH3(g)

 ЛЦИдаЁзДдЊНтОіЮЪЬтЬьЬьСЗЯЕСаД№АИ
ЛЦИдаЁзДдЊНтОіЮЪЬтЬьЬьСЗЯЕСаД№АИ Ш§ЕувЛВтПьРжжмМЦЛЎЯЕСаД№АИ
Ш§ЕувЛВтПьРжжмМЦЛЎЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃКВЛЯъ ЬтаЭЃКЕЅбЁЬт
 C(g)+D(s)ЁЃДяЕНЦНКтЪБЃЌВтЕУбЙЧПЮЊдбЙЧПЕФ5/6ЁЃдђAЕФзЊЛЏТЪЮЊЃЈ ЃЉ
C(g)+D(s)ЁЃДяЕНЦНКтЪБЃЌВтЕУбЙЧПЮЊдбЙЧПЕФ5/6ЁЃдђAЕФзЊЛЏТЪЮЊЃЈ ЃЉ| AЃЎ25% | BЃЎ40% | CЃЎ50% | DЃЎ75% |
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃКВЛЯъ ЬтаЭЃКЕЅбЁЬт
 N2O3(g)+O2(g), ЂкN2O3(g)
N2O3(g)+O2(g), ЂкN2O3(g) N2O(g)+O2(g).дкШнЛ§ЮЊ2LЕФУмБеШнЦїжаГфШы8mol N2O5,МгШШЕНtЁц,ДяЕНЦНКтзДЬЌКѓO2ЮЊ9mol,N2O3ЮЊ3.4mol.дђtЁцЪБЗДгІЂйЕФЦНКтГЃЪ§ЮЊЃЈЃЉ
N2O(g)+O2(g).дкШнЛ§ЮЊ2LЕФУмБеШнЦїжаГфШы8mol N2O5,МгШШЕНtЁц,ДяЕНЦНКтзДЬЌКѓO2ЮЊ9mol,N2O3ЮЊ3.4mol.дђtЁцЪБЗДгІЂйЕФЦНКтГЃЪ§ЮЊЃЈЃЉ| AЃЎ10.7 | BЃЎ8.5 | CЃЎ9.6 | DЃЎ10.2 |
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃКВЛЯъ ЬтаЭЃКЕЅбЁЬт
 N2O4(g)ЃЌдквЛЖЈЬѕМўЯТДяЕНЦНКтЃЌдкЮТЖШВЛБфЪБЃЌгћЪЙЕФБШжЕдіДѓЃЌгІВЩШЁЕФДыЪЉЪЧ(ЁЁЁЁ)
N2O4(g)ЃЌдквЛЖЈЬѕМўЯТДяЕНЦНКтЃЌдкЮТЖШВЛБфЪБЃЌгћЪЙЕФБШжЕдіДѓЃЌгІВЩШЁЕФДыЪЉЪЧ(ЁЁЁЁ)| AЃЎЂйЂк | BЃЎЂкЂл |
| CЃЎЂйЂм | DЃЎЂлЂм |
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃКВЛЯъ ЬтаЭЃКЕЅбЁЬт
 2SO3етЪЧвЛИіе§ЗДгІЗХШШЕФПЩФцЗДгІЁЃЯТСагаЙиЫЕЗЈжаДэЮѓЕФЪЧЃЈ ЃЉ
2SO3етЪЧвЛИіе§ЗДгІЗХШШЕФПЩФцЗДгІЁЃЯТСагаЙиЫЕЗЈжаДэЮѓЕФЪЧЃЈ ЃЉ| AЃЎЪЙгУДпЛЏМСЪЧЮЊСЫМгПьЗДгІЫйТЪЃЌЬсИпЩњВњаЇТЪ |
| BЃЎЩЯЪіЬѕМўЯТЃЌSO2ВЛПЩФм100ЃЅзЊЛЏЮЊSO3ЃЛ |
| CЃЎДяЕНЦНКтзДЬЌЪБЃЌSO2ХЈЖШгыSO3ХЈЖШЯрЕШ |
| DЃЎДяЕНЦНКтзДЬЌЪБЃЌSO2ЕФЯћКФЫйТЪгыSO2ЕФЩњГЩЫйТЪЯрЕШ |
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃКВЛЯъ ЬтаЭЃКЕЅбЁЬт
 3C(g) + D(g),ЯжЗжБ№ДгСНЬѕЭООЖНЈСЂЦНКтЃЌЭООЖЂёЃКAЁЂBЕФГѕЪМХЈЖШОљЮЊ2 mol/LЃЛЭООЖЂђЃКCЁЂDЕФГѕЪМХЈЖШЗжБ№ЮЊ6 mol/LКЭ2 mol/L.ЯТСаа№Ъіе§ШЗЕФЪЧЃЈ ЃЉ
3C(g) + D(g),ЯжЗжБ№ДгСНЬѕЭООЖНЈСЂЦНКтЃЌЭООЖЂёЃКAЁЂBЕФГѕЪМХЈЖШОљЮЊ2 mol/LЃЛЭООЖЂђЃКCЁЂDЕФГѕЪМХЈЖШЗжБ№ЮЊ6 mol/LКЭ2 mol/L.ЯТСаа№Ъіе§ШЗЕФЪЧЃЈ ЃЉВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃКВЛЯъ ЬтаЭЃКЕЅбЁЬт
 N2O4(g),ДяЕНЦНКтКѓЃЌдйЯђИУШнЦїжаГфШыamol NO2ЃЌДяЕНЦНКтКѓгыдРДЦНКтБШНЯе§ШЗЕФЪЧ(ЁЁЁЁ)
N2O4(g),ДяЕНЦНКтКѓЃЌдйЯђИУШнЦїжаГфШыamol NO2ЃЌДяЕНЦНКтКѓгыдРДЦНКтБШНЯе§ШЗЕФЪЧ(ЁЁЁЁ)| AЃЎNO2ЕФзЊЛЏТЪЬсИп | BЃЎбеЩЋБфЧГ |
| CЃЎбЙЧПЮЊдРДЕФСНБЖ | DЃЎЦНОљЯрЖдЗжзгжЪСПМѕаЁ |
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃКВЛЯъ ЬтаЭЃКЕЅбЁЬт
 BЃЈgЃЉЃЌдкЯрЭЌЬѕМўЯТЃЌШєЗжБ№дйЯђШнЦїжаЭЈШывЛЖЈСПЕФAЦјЬхЛђBЦјЬхЃЌжиаТДяЕНЦНКтКѓЃЌШнЦїФкAЕФЬхЛ§ЗжЪ§БШдЦНКтЪБ
BЃЈgЃЉЃЌдкЯрЭЌЬѕМўЯТЃЌШєЗжБ№дйЯђШнЦїжаЭЈШывЛЖЈСПЕФAЦјЬхЛђBЦјЬхЃЌжиаТДяЕНЦНКтКѓЃЌШнЦїФкAЕФЬхЛ§ЗжЪ§БШдЦНКтЪБ| AЃЎЖМдіДѓ | BЃЎЖММѕаЁ |
| CЃЎЧАепдіДѓКѓепМѕаЁ | DЃЎЧАепМѕЩйКѓепдіДѓ |
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃКВЛЯъ ЬтаЭЃКЕЅбЁЬт
AЃЎфхЫЎжагаЦНКтЃКBr2+ H2O  HBr+ HBrO МгШы AgNO3ШмвККѓЃЌШмвКбеЩЋБфЧГ HBr+ HBrO МгШы AgNO3ШмвККѓЃЌШмвКбеЩЋБфЧГ |
BЃЎЖдCO(g) + NO2 (g) CO2 (g)+ NO(g) ЦНКтЬхЯЕЃЌдіДѓбЙЧППЩЪЙбеЩЋБфЩю CO2 (g)+ NO(g) ЦНКтЬхЯЕЃЌдіДѓбЙЧППЩЪЙбеЩЋБфЩю |
| CЃЎЙЄвЕЩЯКЯГЩSO3ЃЌЪЙгУДпЛЏМС |
| DЃЎКЯГЩ NH3ЗДгІЃЌдкНЯИпЮТЖШЯТНјаа |
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com