
【题目】(1)有pH均为2的a盐酸、b醋酸两瓶溶液,与足量锌反应放出等体积H2所需时间的长短顺序是a____b(用“>”、“<”、“=”表示,下同);完全中和等物质的量的NaOH溶液需两种酸的体积大小顺序是a____b。
(2)已知水在25℃和95℃时,其电离平衡曲线如下图所示:
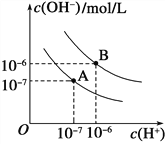
①则25℃时水的电离平衡曲线应为________(填“A”或“B”)。
②95℃时水的离子积KW=___________________。
③25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为____________。
④95℃时,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是_____________。
【答案】>>A1×10-1210:1pH1+pH2=14或a+b=14
【解析】(1)醋酸为弱酸,等pH时醋酸的浓度较大,与锌反应时醋酸的速率大,则生成等体积的氢气,盐酸反应的时间较长,完全中和等物质的量的NaOH溶液,需要醋酸的体积较小;
(2)①曲线A条件下Kw=c(H+)×c(OH-)=10-7×10-7=10-14,曲线B条件下c(H+)=c(OH-)=10-6 mol/L,Kw=c(H+)c(OH-)=10-12 ;水的电离时吸热过程,加热促进电离,所以A曲线代表25℃时水的电离平衡曲线;
②B为95℃水的电离平衡曲线,纯水中c(H+)=c(OH-)=10-6 mol/L,Kw=c(H+)c(OH-)=10-12 ;
③25℃时所得混合溶液的pH=7,溶液呈中性即酸碱恰好中和,即n(OH-)=n(H+),则V(NaOH)10-5 molL-1=V(H2SO4)10-4 molL-1,得V(NaOH):V(H2SO4)=10:1;
④强酸的pH=a,强碱的pH=b,由95℃时,若100体积的某强酸溶液与1体积的某强碱溶液混和后溶液呈中性,即n(H+)=n(OH-),则100×10-a=1×10b-12,102-a=10b-12,即2-a=b-12,则a+b=14。


 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A.同系物一定符合同一通式
B.同分异构体一定具有相同的最简式
C.相对分子质量相等的两种有机物必定是同分异构体
D.同分异构体间不一定有相似的化学性质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列生成乙酸的方法中,最符合绿色化学思想的是
A. 乙酸乙酯水解:CH3COOC2H5+H2O![]() CH3COOH+C2H5OH
CH3COOH+C2H5OH
B. 乙醛氧化:2CH3CHO+O2![]() 2CH3COOH
2CH3COOH
C. 淀粉发酵:淀粉→葡萄糖→乙醇→乙酸
D. 丁烷氧化:2CH3CH2CH2CH3+5O2![]() 4CH3COOH+2H2O
4CH3COOH+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关细胞中化合物的叙述中,不正确的是
A. 淀粉、脂肪、蛋白质和DNA、RNA都是大分子物质
B. 脂肪、肝糖原、肌糖原、淀粉均为细胞内储存能量的物质
C. 构成细胞的任何一种化学元素都能在无机自然界找到
D. 蛋白质是含量最多的有机物,是生命活动的主要承担者
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表示下列反应的离子方程式是
A. 用石墨作电极电解CuCl2溶液:2Cl-+2H2O![]() 2OH-+Cl2↑+H2↑
2OH-+Cl2↑+H2↑
B. 0.01mol/LNH4Al(SO4)2溶液与0.02mol/LBa(OH)2溶液等体积混合:Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O
C. 将少量二氧化硫通入次氯酸钠溶液:SO2+ClO-+2OH-=SO42-+Cl-+H2O
D. Ca(HCO3)2溶液与过量NaOH溶液反应:Ca2++HCO3-+OH-=CaCO3+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有三组溶液:①汽油和氯化钠溶液 ②39%的酒精溶液 ③碘的水溶液,分离以上各混合液的正确方法依次是( )
A.分液、萃取、蒸馏
B.分液、蒸馏、萃取
C.萃取、蒸馏、分液
D.蒸馏、萃取、分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子一定能在指定溶液中大量共存的是( )
A.使酚酞变红色的溶液中:Na+、Al3+、SO42-、Cl-
B![]() =1×10-13mol·L-1的溶液中:NH4+、Ca2+、Cl-、NO3-
=1×10-13mol·L-1的溶液中:NH4+、Ca2+、Cl-、NO3-
C.与Al反应能放出H2的溶液中:Fe2+、K+、NO3-、SO42-
D.水电离的c(H+)=1×10-13mol·L-1的溶液中:K+、Na+、AlO2-、CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自2013年以来我国“雾霾”污染日益严重。中科院“大气灰霾追因与控制”项目针对北京强霾过程进行分析,强霾过程中,出现了大量有毒有害的含氮有机颗粒物。燃煤和机动车尾气是氮氧化物的上要来源。现在对其中的一些气休进行了一定的研究:
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。
已知:
①CH4(g)+4NO2(g)=4NO(g)+ CO2(g)+2H2O(g) △H=-574kJ·mol-l
②CH4(g)+4NO(g)=2N2(g)+ CO2(g)+ 2H2O(g) △H=-1160kJ·mol-l
③H2O(g)=H2O(1) △H=-44.0 kJ·mol-l
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(1)的热化学方程式_______。
(2)为了减轻大气污染,人们提出在汽车尾气排气管口采用催化剂将NO和CO转化成无污染气体参与大气循环。T℃时,将等物质的量的NO和CO充入容积为2L的密闭容器中,保持温度和体积不变,反应过程中NO的物质的量随时间变化如右图所示。

① 写出该反应的化学方程式_______________。
②10 min内该反应的速率v(N2)=_______;该反应达平衡时CO的转化率为________;T℃时该化学反应的平衡常数K=____________。
③若该反应△H<0,在恒容的密闭容器中,反应达平衡后,改变某一条件,下列示意图正确的是__________。

④一定温度下,在恒容密闭容器中充入一定量NO和CO进行该反应,能判断反应已达到化学平衡状态的是__________。
a.容器中压强不再变化 b.CO2的浓度不再改变
c.2v正(NO)=v逆(N2) d.气体的密度保持不变
(3)以燃料电池为代表的新能源的推广使用能大大降低污染物的排放。如图是一种甲醚燃料电池结构,请写出该电池负极的电极反应式_______________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com