
【题目】有A、B、C、D、E五种元素,其中A、B、C属于同一周期,A元素原子最外层p能级的电子数等于次外层的电子总数,C元素原子最外层中有2个未成对电子。已知C、D、E元素原子核内的质子数均与中子数相等,且C元素可分别与A、B、D、E生成![]() 型化合物,在
型化合物,在![]() 中,D与C的质量比为7:8,在
中,D与C的质量比为7:8,在![]() 中,E与C的质量比为1:1。
中,E与C的质量比为1:1。
请回答下列问题:
(1)写出A、E两种元素的元素符号:A ____________ 、E ____________ 。
(2)写出D元素原子的核外电子排布式: ____________ 。
(3)指出E在元素周期表中的位置: ____________ 。
(4)比较A、B、C三种元素的第一电离能的大小: ____________ (填元素符号,下同)。
(5)比较D元素和E元素的电负性的相对大小: ____________ 。
【答案】C S ls22s22p63s23p2 第三周期第ⅥA族 C<O<N Si<S
【解析】
A元素原子最外层p能级的电子数等于次外层的电子总数,则A为C元素;A、B、C属于同一周期,C元素原子最外层中有2个未成对电子,则C为O;在![]() 中,D与C的质量比为7:8,则D的相对原子质量为28,即D为Si元素;在
中,D与C的质量比为7:8,则D的相对原子质量为28,即D为Si元素;在![]() 中,E与C的质量比为1:1,则E的相对原子质量为32,即E为S元素;剩下B为N元素;综上:A为C元素,B为N元素,C为O元素,D为Si元素,E为S元素。
中,E与C的质量比为1:1,则E的相对原子质量为32,即E为S元素;剩下B为N元素;综上:A为C元素,B为N元素,C为O元素,D为Si元素,E为S元素。
(1)A、E两种元素的元素符号:A为C元素,E为S元素;
(2)D元素为镁,核电荷数为12,原子的核外电子排布式:ls22s22p63s23p2;
(3)E为硫元素,核电荷数为16,元素周期表中的位置:第三周期第ⅥA族;
(4)由于N原子2p轨道半充满,结合电离能在同周期时,越往右越大,因而A、B、C三种元素的第一电离能的大小:C<O<N;
(5)电负性同周期时,越往右越大,D元素和E元素的电负性的相对大小:Si<S。


科目:高中化学 来源: 题型:
【题目】F2和Xe在一定条件下可生成XeF2、XeF4和XeF6三种氟化氙,它们都是极强的氧化剂(其氧化性依次增强),都极易与水反应。已知![]() ,下列推测正确的是( )
,下列推测正确的是( )
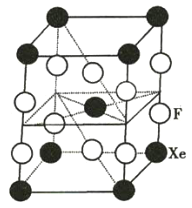
A.XeF2分子中各原子均达到8电子的稳定结构
B.某种氟化氙晶体的基本结构单元如图所示,可推知其化学式为XeF6
C.XeF4与水反应时,每生成2 mol Xe转移8 mol电子
D.XeF2加入水中,在水的作用下,将生成Xe和F2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、D、E的原子序数依次增大,B、E位于同主族,四种元素的一种化合物的结构式如图所示。下列说法不正确的是
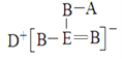
A.B的最简单氢化物的沸点比E的高
B.D和E形成的三核二元化合物的水溶液中,阴、阳离子的浓度之比小于1:2
C.化合物DA的水溶液呈碱性
D.同时含有A、B、D、E四种元素的盐至少有两种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 、
、![]() 、
、![]() 、
、![]() 是四种短周期元素,
是四种短周期元素,![]() 、
、![]() 、
、![]() 同周期,
同周期,![]() 、
、![]() 同主族。
同主族。![]() 的原子结构示意图为
的原子结构示意图为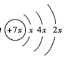 ,
,![]() 、
、![]() 形成的化合物的电子式为
形成的化合物的电子式为![]() ,下列说法正确的是( )
,下列说法正确的是( )
A.原子半径:![]()
B.电负性:![]()
C.原子序数:![]()
D.最高价氧化物对应水化物的酸性:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是A、B、C、D、E五种短周期元素的某些性质,下列判断正确的是( )
元素 | A | B | C | D | E |
最低化合价 | -4 | -2 | -1 | -2 | -1 |
电负性 | 2.5 | 2.5 | 3.0 | 3.5 | 4.0 |
A.C、D、E的简单氢化物的稳定性:C>D>E
B.元素A的原子最外层中无自旋状态相同的电子
C.元素B、C之间不可能形成化合物
D.与元素B同周期且在该周期中第一电离能最小的元素的单质能与![]() 发生置换反应
发生置换反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的化合物在国防建设、工农业生产和生活中有广泛的用途。请回答下列问题:
(1)已知25℃,NH3·H2O的Kb=1.8×105,H2SO3的Ka1=1.3×102,Ka2=6.2×108。
① 若氨水的浓度为2.0 mol·L-1,溶液中的c(OH)=_________________mol·L1。
②将SO2通入2.0 mol·L-1氨水中(溶液的体积保持不变),当c(OH)降至1.0×107 mol·L1时,溶液中的![]() =______;(NH4)2SO3溶液中的质子守恒____________。
=______;(NH4)2SO3溶液中的质子守恒____________。
(2)室温时,向100 mL 0.1 mol·L-1HCl溶液中滴加0.1 mol·L-1氨水,得到溶液pH与氨水体积的关系曲线如图所示:
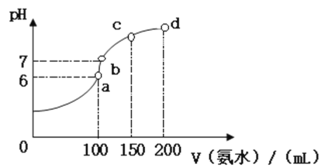
①试分析图中a、b、c、d四个点,水的电离程度最大的是_________;
②在b点,溶液中各离子浓度由大到小的排列顺序是___________;
③写出a点混合溶液中下列算式的精确结果(不能近似计算):c(Cl-)- c(NH4+)=____________,c(H+)- c(NH3·H2O)=____________;
(3)亚硝酸(HNO2)的性质和硝酸类似,但它是一种弱酸。常温下亚硝酸的电离平衡常数Ka=5.1×10-4;H2CO3的Ka1=4.4×10-7,Ka2=4.7×10-11。常温下向含有2mol碳酸钠的溶液中加入含1mol HNO2的溶液后,溶液中CO32-、HCO3-和NO2-的浓度由大到小的顺序是______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
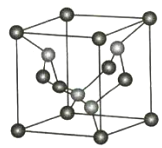
【题目】已知C3N4晶体的硬度与金刚石相差不大,且原子间均以单键结合,下列关于C3N4的说法错误的是
A.该晶体中碳原子和氮原子的最外层都满足8电子稳定结构
B.C3N4晶体中C-N键的键长比金刚石的C-C键的键长要长
C.C3N4晶体中每个C原子连接4个N原子,每个N原子连接3个C原子
D.该晶体与金刚石相似,都是原子间以共价键形成的空间网状结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】BMO(Bi2MoO6)是一种高效光催化剂,可用于光催化降解苯酚,原理如图所示。下列说法不正确的是( )
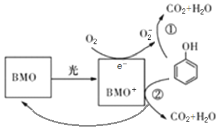
A.O2-不如O2结构稳定
B.①和②中被降解的苯酚的物质的量之比为1:1
C.降解产物的分子中只含有极性共价键
D.该过程的总反应:![]() +7O2
+7O2![]() 6CO2+3H2O
6CO2+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请按要求填空:
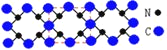
(1)C、N元素形成的新材料具有如图所示的结构该晶体的化学式为________________。
![]() C(位于顶点和面心)
C(位于顶点和面心)![]() N
N
(2)氮化碳和氮化硅晶体结构相似,是新型的非金属高温陶瓷材料,它们的硬度大、熔点高、化学性质稳定。
①氮化硅的硬度________(填“大于”或“小于”)氮化碳的硬度,原因是___________________________。
②已知氮化硅的晶体结构中,原子间都以单键相连,且氮原子与氮原子不直接相连、硅原子与硅原子不直接相连,同时每个原子都满足最外层8电子稳定结构,请写出氮化硅的化学式:______________。
(3)第ⅢA、VA元素组成的化合物GaN、GaP、CaAs等是人工合成的新型半导体材料,其晶体结构与晶体硅相似。在GaN晶体中,每个Ga原子与________个N原子相连,与同一个Ga原子相连的N原子构成的空间构型为________。在四大晶体类型中,GaN属于________晶体。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com