
【题目】短周期元素A、B、D、E的原子序数依次增大,B、E位于同主族,四种元素的一种化合物的结构式如图所示。下列说法不正确的是
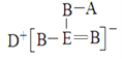
A.B的最简单氢化物的沸点比E的高
B.D和E形成的三核二元化合物的水溶液中,阴、阳离子的浓度之比小于1:2
C.化合物DA的水溶液呈碱性
D.同时含有A、B、D、E四种元素的盐至少有两种
【答案】B
【解析】
短周期元素A、B、D、E的原子序数依次增大,四种元素组成的一种化合物的结构式为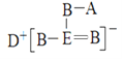 , B与A成键时,B形成两个共价键,位于ⅥA族,B、E位于同主族,则B为O, E为S ,E能够形成4个共价键,有一对配位键,得到D给的一个电子,达到稳定结构; D能够形成+1价阳离子,其原子序数大于O,则D为Na;A只能形成1个共价键,则A位于ⅠA族,结合原子序数大小可知,A为H元素,据此解答。
, B与A成键时,B形成两个共价键,位于ⅥA族,B、E位于同主族,则B为O, E为S ,E能够形成4个共价键,有一对配位键,得到D给的一个电子,达到稳定结构; D能够形成+1价阳离子,其原子序数大于O,则D为Na;A只能形成1个共价键,则A位于ⅠA族,结合原子序数大小可知,A为H元素,据此解答。
A. 根据分析,B、E位于同主族,属于O和S,B的最简单氢化物是水,分子中含有氢键,E的最简单氢化物是硫化氢,水的沸点高于硫化氢的沸点,故A正确;
B.D为Na,E为S, D和E形成的三核二元化合物是Na2S,Na2S是强碱弱酸盐,S2-水解生成HS-和OH-,溶液中阴离子的浓度增大,阴、阳离子的浓度之比大于1:2,故B错误;
C.A为H元素,D为Na;化合物DA为NaH,可与水反应生成氢氧化钠和氢气,其水溶液呈碱性,故C正确;
D.A为H元素,B为O;D为Na;E为S,同时含有A、B、D、E四种元素的盐有NaHSO4或NaHSO3,至少有两种,故D正确;
答案选B。


科目:高中化学 来源: 题型:
【题目】部分等电子体类型、代表物质及对应的空间构型如表所示:
等电子类型 | 代表物质 | 空间构型 |
四原子24电子等电子体 | SO3 | 平面三角形 |
四原子26电子等电子体 | SO32- | 三角锥形 |
五原子32电子等电子体 | CCl4 | 四面体形 |
六原子40电子等电子体 | PCl5 | 三角双锥形 |
七原子48电子等电子体 | SF6 | 八面体形 |
请回答下列问题。
(1)请写出下列离子的空间构型:
![]() ____________________,
____________________,![]() ____________________,
____________________,![]() ____________________。
____________________。
(2)由第2周期元素原子构成,与F2互为等电子体的离子是__________。
(3)![]() 的空间构型如图1所示,请再按照图1的表示方法在图2中表示出
的空间构型如图1所示,请再按照图1的表示方法在图2中表示出![]() 分子中O、S、F原子的空间位置。已知
分子中O、S、F原子的空间位置。已知![]() 分子中O、S间为共价双键,S、F间为共价单键。__________。
分子中O、S间为共价双键,S、F间为共价单键。__________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白藜芦醇在保健品领域有广泛的应用。其合成路线如下:
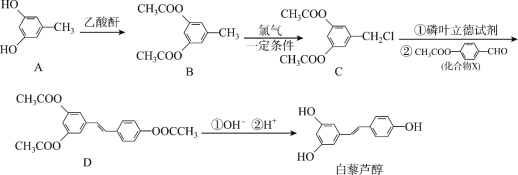
回答下列问题:
(1)物质B中含氧官能团的名_______。B→C的反应类型为___________。
(2)1mol有机物D最多能消耗NaOH为 _________mol,白藜芦醇遇足量浓溴水时反应的化学方程式为____________。
(3)已知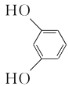 的系统名称1,3-苯二酚,则A的名称为________,已知乙酸酐(
的系统名称1,3-苯二酚,则A的名称为________,已知乙酸酐(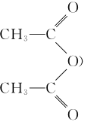 )极易与水反应生成乙酸,是很好的吸水剂。试从平衡移动的角度分析A→B反应中用乙酸酐代替乙酸的目的是__________。
)极易与水反应生成乙酸,是很好的吸水剂。试从平衡移动的角度分析A→B反应中用乙酸酐代替乙酸的目的是__________。
(4)C的核磁共振氢谱有_________组峰,写出满足下列条件的化合物X的所有同分异构体的结构简式__________。
①具有与X相同的官能团②属于醋酸酯
(5)利用甲苯、磷叶立德试剂和乙醛为原料可以合成![]() (涉及无机试剂自选),请写出合成路线__________。
(涉及无机试剂自选),请写出合成路线__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制250mL一定物质的量浓度的盐酸,并用该盐酸滴定未知浓度的NaOH溶液,下列实验操作或说法错误的是
A.实验前,容量瓶和酸式滴定管都需要检查是否漏液
B.若NaOH溶液因久置而变质(含少量Na2CO3),用甲基橙作指示剂,对滴定结果无影响
C.若配制盐酸标准溶液定容时俯视刻度线,则所测定NaOH溶液的浓度偏小
D.当最后一滴盐酸标准液滴入锥形瓶中,溶液颜色由黄色变为橙色时,即达滴定终点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在粗制CuSO4·5H2O晶体中常含有杂质Fe2+。在提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,下列物质可采用的是__。
A.KMnO4 B.H2O2 C.Cl2水 D.HNO3
然后再加入适当物质调整至溶液pH=4,使Fe3+转化为Fe(OH)3,可以达到除去Fe3+而不损失CuSO4的目的,调整溶液pH可选用下列中的__。
A.NaOH B.NH3·H2O C.CuO D.Cu(OH)2
(2)甲同学怀疑调整至溶液pH=4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,已知Ksp(AmBn)=[c(An+)]m.[c(Bm-)]n,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp=8.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1×10-5mol·L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0mol·L-1,则Cu(OH)2开始沉淀时溶液的pH为__,Fe3+完全沉淀时溶液的pH为__,通过计算确定上述方案__(填“可行”或“不可行”)。(提示:lg2=0.3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了测定实验室长期存放的Na2SO3固体的纯度,准确称取M g固体样品,配成250 mL溶液。设计了以下两种实验方案:
方案I:取50.00 mL上述溶液→加入足量的盐酸酸化的BaCl2溶液→操作I→洗涤→操作Ⅱ→称量,得到沉淀的质量为m1 g
方案Ⅱ:取50.00 mL上述溶液,用a mol/L 的酸性KMnO4溶液进行滴定。
实验中所记录的数据如下表:
滴定次数 实验数据 | 1 | 2 | 3 | 4 |
待测溶液体积/mL | 50.00 | 50.00 | 50.00 | 50.00 |
滴定管初读数/mL | 0.00 | 0.20 | 0.10 | 0.15 |
滴定管末读数/mL | 20.95 | 21.20 | 20.15 | 21.20 |
(1)配制250 mL Na2SO3溶液时,必须用到的实验仪器有:烧杯、玻棒、滴管、药匙和_______、________。
(2)操作I为______________,操作Ⅱ为______________。
(3)在方案Ⅱ中滴定终点的判断方法是_______________________________。
(4)在方案Ⅱ中发生的离子反应方程式为____________________________。
(5)根据方案Ⅱ所提供的数据,计算Na2SO3的纯度为___________。(写成分数形式)
(6)方案Ⅱ中氧化还原滴定过程中,导致待测液Na2SO3浓度变小的是_____(填序号)。
a.用碱式滴定管量取50mL待测液过程时,开始仰视,滴定结束时俯视
b.用碱式滴定管量取50mL待测液过程时,一开始有气泡,滴定结束后没气泡
c.酸式滴定管用蒸馏水润洗后,没有用酸性KMnO4溶液多次润洗
d.锥形瓶用蒸馏水润洗后,直接装50.00mL的待测液
e.滴定过程时,开始时平视,滴定结束时仰视
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种元素,其中A、B、C属于同一周期,A元素原子最外层p能级的电子数等于次外层的电子总数,C元素原子最外层中有2个未成对电子。已知C、D、E元素原子核内的质子数均与中子数相等,且C元素可分别与A、B、D、E生成![]() 型化合物,在
型化合物,在![]() 中,D与C的质量比为7:8,在
中,D与C的质量比为7:8,在![]() 中,E与C的质量比为1:1。
中,E与C的质量比为1:1。
请回答下列问题:
(1)写出A、E两种元素的元素符号:A ____________ 、E ____________ 。
(2)写出D元素原子的核外电子排布式: ____________ 。
(3)指出E在元素周期表中的位置: ____________ 。
(4)比较A、B、C三种元素的第一电离能的大小: ____________ (填元素符号,下同)。
(5)比较D元素和E元素的电负性的相对大小: ____________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.熔融状态下硫酸氢钾中的离子键、共价键均被破坏,形成定向移动的离子,因而能够导电
B.F2、Cl2、Br2、I2的熔沸点逐渐升高,是因为分子间作用力越来越大
C.NH3和Cl2两种分子中,每个原子的最外层都达到8电子的稳定结构
D.HF、HCl、HBr、HI的稳定性逐渐减弱,沸点逐渐升高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com