
【题目】氮的化合物在国防建设、工农业生产和生活中有广泛的用途。请回答下列问题:
(1)已知25℃,NH3·H2O的Kb=1.8×105,H2SO3的Ka1=1.3×102,Ka2=6.2×108。
① 若氨水的浓度为2.0 mol·L-1,溶液中的c(OH)=_________________mol·L1。
②将SO2通入2.0 mol·L-1氨水中(溶液的体积保持不变),当c(OH)降至1.0×107 mol·L1时,溶液中的![]() =______;(NH4)2SO3溶液中的质子守恒____________。
=______;(NH4)2SO3溶液中的质子守恒____________。
(2)室温时,向100 mL 0.1 mol·L-1HCl溶液中滴加0.1 mol·L-1氨水,得到溶液pH与氨水体积的关系曲线如图所示:
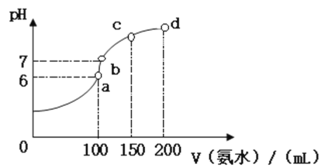
①试分析图中a、b、c、d四个点,水的电离程度最大的是_________;
②在b点,溶液中各离子浓度由大到小的排列顺序是___________;
③写出a点混合溶液中下列算式的精确结果(不能近似计算):c(Cl-)- c(NH4+)=____________,c(H+)- c(NH3·H2O)=____________;
(3)亚硝酸(HNO2)的性质和硝酸类似,但它是一种弱酸。常温下亚硝酸的电离平衡常数Ka=5.1×10-4;H2CO3的Ka1=4.4×10-7,Ka2=4.7×10-11。常温下向含有2mol碳酸钠的溶液中加入含1mol HNO2的溶液后,溶液中CO32-、HCO3-和NO2-的浓度由大到小的顺序是______ 。
【答案】0.6×102 0.62 c(H+)+c(HSO3-)+2c(H2SO3)=c(NH3·H2O)+c(OH-) a c(Cl-)= c(NH4+)>c(OH-)=c(H+) 10-6-10-8 10-8 c(HCO3-)>c(NO2-)>c(CO32-)
【解析】
(1)①NH3·H2O电离方程式为NH3·H2ONH4++OH-,c(NH4+)=c(OH-),的Kb= ;
;
②将SO2通入2.0 mol·L-1氨水中(溶液的体积保持不变),当c(OH)降至1.0×107 mol·L1时,溶液呈中性,根据HSO3-的电离平衡常数计算;根据(NH4)2SO3溶液中质子守恒式=电荷守恒-物料守恒;
(2)①根据反应a、b、c、d四个点,a点恰好消耗完H+,溶液中只有NH4Cl,b、c、d三点溶液中均含有NH3H2O,NH4Cl可以促进水的电离,而NH3H2O抑制水的电离,b点溶液呈中性;
②b点溶液为中性,溶质为NH4Cl和NH3H2O,根据电荷守恒分析;
③a点溶液中只有NH4Cl,铵根离子水解使溶液显酸性,根据电荷守恒和质子守恒计算;
(3)弱酸电离常数越大,酸性越强,其酸根离子水解程度越小。
(1)①NH3·H2O电离方程式为NH3·H2ONH4++OH-,c(NH4+)=c(OH-),的Kb=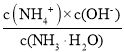 ,c(OH-)=
,c(OH-)=![]() =
=![]() =0.6×102 mol·L1;
=0.6×102 mol·L1;
②将SO2通入2.0 mol·L-1氨水中(溶液的体积保持不变),当c(OH)降至1.0×107 mol·L1时,溶液呈中性,c(OH)=c(H+)=1.0×107 mol·L1根据HSO3-H++ SO32-,电离平衡常数Ka2=![]() =6.2×108,则
=6.2×108,则![]() =
=![]() =0.62; (NH4)2SO3溶液电荷守恒:c(NH4+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-),物料守恒:c(NH4+)+ c(NH3·H2O)=2c(SO32-)+2c(HSO3-)+2c(H2SO3),质子守恒=电荷守恒-物料守恒=c(H+)+c(HSO3-)+2c(H2SO3)=c(NH3H2O)+ c(OH-);
=0.62; (NH4)2SO3溶液电荷守恒:c(NH4+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-),物料守恒:c(NH4+)+ c(NH3·H2O)=2c(SO32-)+2c(HSO3-)+2c(H2SO3),质子守恒=电荷守恒-物料守恒=c(H+)+c(HSO3-)+2c(H2SO3)=c(NH3H2O)+ c(OH-);
(2)①根据反应a、b、c、d四个点,a点恰好消耗完H+,溶液中只有NH4Cl,b、c、d三点溶液中均含有NH3H2O,NH4Cl可以促进水的电离,而NH3H2O抑制水的电离,b点溶液呈中性,所以a点水的电离程度最大;
②b点溶液为中性,c(OH-)= c(H+),溶质为NH4Cl和NH3H2O,溶液中存在电荷守恒式为:c(NH4+)+ c(H+)= c(Cl-)+c(OH-),则c(NH4+)= c(Cl-),水的电离是极弱的,离子浓度的大小为c(NH4+)=c(Cl-)>c(H+)=c(OH-);
③a点溶液中只有NH4Cl,铵根离子水解使溶液显酸性,pH=6,即c(H+)=10-6mol/L,c(OH-)=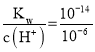 =10-8 mol/L,溶液中存在电荷守恒式为:c(NH4+)+c(H+)= c(Cl-)+c(OH-),c(Cl-)- c(NH4+)= c(H+)- c(OH-)=10-6mol/L-10-8 mol/L=(10-6-10-8) mol/L;溶液中存在质子守恒:c(H+) = c(OH-)+ c(NH3H2O) ,c(H+)- c(NH3·H2O)= c(OH-)=10-8 mol/L;
=10-8 mol/L,溶液中存在电荷守恒式为:c(NH4+)+c(H+)= c(Cl-)+c(OH-),c(Cl-)- c(NH4+)= c(H+)- c(OH-)=10-6mol/L-10-8 mol/L=(10-6-10-8) mol/L;溶液中存在质子守恒:c(H+) = c(OH-)+ c(NH3H2O) ,c(H+)- c(NH3·H2O)= c(OH-)=10-8 mol/L;
(3)由亚硝酸的电离平衡常数Ka=5.1×10-4;H2CO3的Ka1=4.4×10-7,Ka2=4.7×10-11,可知溶液中完全反应生成等物质的量的Na2CO3、NaHCO3和NaNO2,可判断水解程度大小顺序为CO32>NO2>HCO3,水解生成HCO3,所以溶液中CO32离子、HCO3离子和NO2离子的浓度大小关系为c(HCO3)>c(NO2)>c(CO32)。


科目:高中化学 来源: 题型:
【题目】下列有关苯分子的说法不正确的是( )
A.苯分子中![]() 原子采用
原子采用![]() 杂化,形成夹角为
杂化,形成夹角为![]() 的三个
的三个![]() 杂化轨道
杂化轨道
B.每个碳原子有一个与碳环平面垂直的未参与杂化的![]() 轨道,以“肩并肩”方式相互重叠,形成大
轨道,以“肩并肩”方式相互重叠,形成大![]() 键
键
C.苯分子中最多有六个原子共面,六个碳碳键完全相同
D.苯分子中的大![]() 键可表示为
键可表示为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在粗制CuSO4·5H2O晶体中常含有杂质Fe2+。在提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,下列物质可采用的是__。
A.KMnO4 B.H2O2 C.Cl2水 D.HNO3
然后再加入适当物质调整至溶液pH=4,使Fe3+转化为Fe(OH)3,可以达到除去Fe3+而不损失CuSO4的目的,调整溶液pH可选用下列中的__。
A.NaOH B.NH3·H2O C.CuO D.Cu(OH)2
(2)甲同学怀疑调整至溶液pH=4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,已知Ksp(AmBn)=[c(An+)]m.[c(Bm-)]n,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp=8.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1×10-5mol·L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0mol·L-1,则Cu(OH)2开始沉淀时溶液的pH为__,Fe3+完全沉淀时溶液的pH为__,通过计算确定上述方案__(填“可行”或“不可行”)。(提示:lg2=0.3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表前五周期的一部分,X、Y、Z、R、W、J是6种元素的代号。其中J为0族元素。
X | Y | Z | |
R | |||
W | |||
J |
下列说法正确的是( )
A.基态R原子的轨道表示式为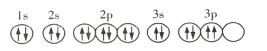
B.![]() 与
与![]() 的半径大小关系为
的半径大小关系为![]()
C.Y的第一电离能大于X的第一电离能
D.X、Y、Z、R、W中,电负性最大的元素为W
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种元素,其中A、B、C属于同一周期,A元素原子最外层p能级的电子数等于次外层的电子总数,C元素原子最外层中有2个未成对电子。已知C、D、E元素原子核内的质子数均与中子数相等,且C元素可分别与A、B、D、E生成![]() 型化合物,在
型化合物,在![]() 中,D与C的质量比为7:8,在
中,D与C的质量比为7:8,在![]() 中,E与C的质量比为1:1。
中,E与C的质量比为1:1。
请回答下列问题:
(1)写出A、E两种元素的元素符号:A ____________ 、E ____________ 。
(2)写出D元素原子的核外电子排布式: ____________ 。
(3)指出E在元素周期表中的位置: ____________ 。
(4)比较A、B、C三种元素的第一电离能的大小: ____________ (填元素符号,下同)。
(5)比较D元素和E元素的电负性的相对大小: ____________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法均正确的组合为
①s-s σ键与s-p σ键的电子云形状相同
②第四周期的元素基态原子中,4s能级只有1个电子的元素共有3种
③钨的配合物离子[W(CO)5OH]-能催化固定CO2,该配离子中钨显0价
④中心原子采取sp3杂化的分子,其立体构型一定是正四面体
⑤2-丁醇中存在手性碳原子
⑥相对分子质量:CH3CH2OH>CH3CHO,所以沸点:CH3CH2OH>CH3CHO
A.②③⑤B.③⑤C.①②④D.④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物K为合成高分子化合物,一种合成K的合成路线如图所示(部分产物及反应条件已略去)。
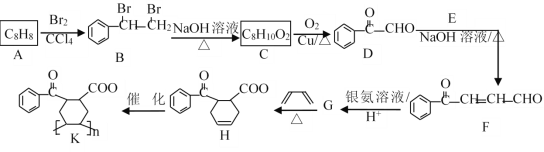
已知:① R1CHO+ R2CH2CHO![]()
![]() +H2O
+H2O
②![]() +
+![]()
![]()
![]()
回答下列问题:
(1)A的名称为_________,F中含氧官能团的名称为___________。
(2)E和G的结构简式分别为________、________。H→K的反应类型为_______反应。
(3)由C生成D的化学方程式为___________。
(4)参照上述合成路线和信息,以甲醛、乙醛为原料(无机试剂任选),设计制取甘油(丙三醇)的合成路线为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L 恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g)![]() M(g)+N(s),所得实验数据如下表:
M(g)+N(s),所得实验数据如下表:
实验 编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | ||
n(X) | n(Y) | n(M) | n(N) | ||
① | 800 | 0.10 | 0.40 | 0.080 | 0.080 |
② | 800 | 0.20 | 0.80 | a | a |
③ | 900 | 0.10 | 0.15 | 0.06 | 0.06 |
下列说法正确的是( )
A.实验① 5min达平衡,平均反应速率v(X)=0.016mol/(L·min)
B.实验②中,该反应的平衡常数K=1
C.实验②中,达到平衡时,a小于0.16
D.正反应为吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学和生活、社会发展息息相关,从古代文物的修复到现在的人工智能,我们时时刻刻能感受到化学的魅力。下列说法不正确的是
A. 银器发黑重新变亮涉及了化学变化
银器发黑重新变亮涉及了化学变化
B. 煤综合利用时采用了干馏和液化等化学方法
煤综合利用时采用了干馏和液化等化学方法
C. 瓷器主要成分属于硅酸盐
瓷器主要成分属于硅酸盐
D. 芯片制造中的“光刻技术”是利用光敏树脂在曝光条件下成像,该过程并不涉及化学变化
芯片制造中的“光刻技术”是利用光敏树脂在曝光条件下成像,该过程并不涉及化学变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com