
【题目】下列说法均正确的组合为
①s-s σ键与s-p σ键的电子云形状相同
②第四周期的元素基态原子中,4s能级只有1个电子的元素共有3种
③钨的配合物离子[W(CO)5OH]-能催化固定CO2,该配离子中钨显0价
④中心原子采取sp3杂化的分子,其立体构型一定是正四面体
⑤2-丁醇中存在手性碳原子
⑥相对分子质量:CH3CH2OH>CH3CHO,所以沸点:CH3CH2OH>CH3CHO
A.②③⑤B.③⑤C.①②④D.④⑥
【答案】A
【解析】
①s能级电子云是球形,p能级电子云是哑铃型,所以ssσ键与spσ键的电子云形状不同,①错误;
②该原子4s能级未填充满,情况之一是按照能级顺序正常填充的结果:1s22s22p63s23p64s1,为K元素,情况之二是按照洪特规则的特例填充的结果:1s22s22p63s23p63d54s1、1s22s22p63s23p63d104s1,为Cr和Cu,所以基态原子的4s能级中只有1个电子的元素共有3种,②正确;
③OH显-1价,CO显O价,故W显O价,③正确;
④中心原子采取sp3杂化的分子,VSEPR模型是正四面体,但其立体构形不一定是正四面体,如:水和氨气分子中中心原子采取sp3杂化,但H2O是V型,NH3是三角锥型,④错误;
⑤与4个不相同的原子或原子团相连的C原子称为手性碳原子,![]() 中,与-OH相连的C符合定义,是手性碳,⑤正确;
中,与-OH相连的C符合定义,是手性碳,⑤正确;
⑥CH3CH2OH分子之间存在氢键,故CH3CH2OH的熔沸点比CH3CHO高,⑥错误;
综上所述:②③⑤正确。
答案选A。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】硫及其化合物具有一定的空间结构。
(1)S单质的常见形式为![]() ,其环状结构如图所示,S原子之间以单键相连,则S原子采取的杂化轨道方式是__________。
,其环状结构如图所示,S原子之间以单键相连,则S原子采取的杂化轨道方式是__________。

(2)气态![]() 分子的立体构型为__________;
分子的立体构型为__________;![]() 的立体构型为__________。
的立体构型为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以高硫铝土矿(主要成分为Al2O3、Fe2O3,还含有少量FeS2)为原料,生产氧化铝并获得Fe3O4的部分工艺流程如下,下列叙述不正确的是

A. 加入CaO可以减少SO2的排放同时生成建筑材料CaSO4
B. 向滤液中通入过量CO2、过滤、洗涤、灼烧沉淀可制得Al2O3
C. 隔绝空气焙烧时理论上反应消耗的n(FeS2)∶n(Fe2O3)=1∶5
D. 烧渣分离可以选择用磁铁将烧渣中的Fe3O4分离出来
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组设计实验探究H2S的性质,装置如图所示。

下列说法正确的是( )
A. 若F中产生黑色沉淀,则说明H2SO4的酸性比H2S强
B. 若G中产生浅黄色沉淀,则说明H2S的还原性比Fe2+强
C. 若H中溶液变红色,则说明H2S是二元弱酸
D. 若E中FeS换成Na2S,该装置也可达到相同的目的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的化合物在国防建设、工农业生产和生活中有广泛的用途。请回答下列问题:
(1)已知25℃,NH3·H2O的Kb=1.8×105,H2SO3的Ka1=1.3×102,Ka2=6.2×108。
① 若氨水的浓度为2.0 mol·L-1,溶液中的c(OH)=_________________mol·L1。
②将SO2通入2.0 mol·L-1氨水中(溶液的体积保持不变),当c(OH)降至1.0×107 mol·L1时,溶液中的![]() =______;(NH4)2SO3溶液中的质子守恒____________。
=______;(NH4)2SO3溶液中的质子守恒____________。
(2)室温时,向100 mL 0.1 mol·L-1HCl溶液中滴加0.1 mol·L-1氨水,得到溶液pH与氨水体积的关系曲线如图所示:
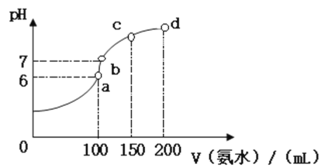
①试分析图中a、b、c、d四个点,水的电离程度最大的是_________;
②在b点,溶液中各离子浓度由大到小的排列顺序是___________;
③写出a点混合溶液中下列算式的精确结果(不能近似计算):c(Cl-)- c(NH4+)=____________,c(H+)- c(NH3·H2O)=____________;
(3)亚硝酸(HNO2)的性质和硝酸类似,但它是一种弱酸。常温下亚硝酸的电离平衡常数Ka=5.1×10-4;H2CO3的Ka1=4.4×10-7,Ka2=4.7×10-11。常温下向含有2mol碳酸钠的溶液中加入含1mol HNO2的溶液后,溶液中CO32-、HCO3-和NO2-的浓度由大到小的顺序是______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化硼(BN)晶体有多种结构。回答下列问题:
(1)六方氮化硼的结构与石墨相似(如图所示),具有层状结构,可作高温润滑剂,但不导电。该晶体中存在的作用力类型有___________,六方氮化硼晶体层内一个硼原子与相邻氮原子构成的空间构型为______________,六方氮化硼不导电的原因是__________。

![]()
(2)六方氮化硼在高温高压下,可以转化为立方氮化硼(如图所示),该晶胞边长为a pm,c原子的坐标参数为(0,0,0),e为(![]() ,
,![]() ,0),f为(
,0),f为(![]() ,0,
,0,![]() )。
)。
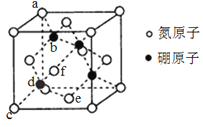
①由题干所给的坐标参数知,d原子的坐标参数为_________。
②B原子填充在N原子的四面体空隙,且占据此类空隙的比例为_________。
③a位置N原子与b位置B原子的距离为________pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种元素位于元素周期表中前四周期,原子序数依次增大。A元素的价电子排布为nsnnpn+1;B元素原子最外层电子数是次外层电子数的3倍;C位于B的下一周期,是本周期最活泼的金属元素;D基态原子的3d原子轨道上的电子数是4s原子轨道上的4倍;E元素原子的4p轨道上有3个未成对电子。回答下列问题(用元素符号表示或按要求作答)。
(1)A、B、C的第一电离能由小到大的顺序为____________,三者电负性由大到小的顺序为_________。
(2)A和E的简单气态氢化物沸点高的是______,其原因是_________。
(3)D3+基态核外电子排布式为_________________。
(4)E基态原子的价电子轨道表示式为___________。
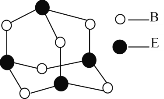
(5)B和E形成分子的结构如图所示,该分子的化学式为_______,E原子的杂化类型为________。
(6)B和C能形成离子化合物R,其晶胞结构如图所示:
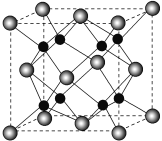
①一个晶胞中含______个B离子。R的化学式为__________。
②晶胞参数为a pm,则晶体R的密度为_____________gcm-3(只列计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在极性分子中,正电荷重心与负电荷重心间的距离称为偶极长,通常用![]() 表示。极性分子的极性强弱与偶极长和电荷量(
表示。极性分子的极性强弱与偶极长和电荷量(![]() )有关,一般用偶极矩(
)有关,一般用偶极矩(![]() )来衡量。分子的偶极矩是偶极长和电荷量的乘积,即
)来衡量。分子的偶极矩是偶极长和电荷量的乘积,即![]() 。在非极性分子中,其正、负电荷重心重合,故
。在非极性分子中,其正、负电荷重心重合,故![]() 为0。试回答下列问题:
为0。试回答下列问题:
(1)HCl、CS2、H2S、SO2四种分子中![]() 的有______________________________。
的有______________________________。
(2)实验测得:![]()
①由此可知,PF3分子的空间构型为____________________;
②BCl3分子的空间构型为____________________,中心原子的杂化方式为____________________。
(3)治癌药物![]() 具有平面四边形结构,Pt处在四边形中心,NH3和Cl分别处在四边形的4个顶点。已知该化合物有两种同分异构体,棕黄色化合物的
具有平面四边形结构,Pt处在四边形中心,NH3和Cl分别处在四边形的4个顶点。已知该化合物有两种同分异构体,棕黄色化合物的![]() ,淡黄色化合物的
,淡黄色化合物的![]() 。试写出两种同分异构体的结构简式:____________________(棕黄色)、____________________(淡黄色),在水中溶解度较大的是____________________(填结构简式)。
。试写出两种同分异构体的结构简式:____________________(棕黄色)、____________________(淡黄色),在水中溶解度较大的是____________________(填结构简式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下HF酸性强于HCN,分别向1Ll mol/L的HF和HCN溶液中加NaOH固体调节pH(忽略温度和溶液体积变化),溶液中 (X表示F或者CN)随pH变化情况如图所示,下列说法不正确的是
(X表示F或者CN)随pH变化情况如图所示,下列说法不正确的是
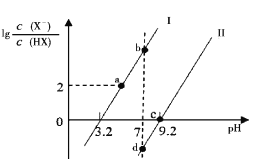
A.直线I对应的是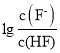
B.I中a点到b点的过程中水的电离程度逐渐增大
C.c点溶液中:![]()
![]()
D.b点溶液和d点溶液相比:cb(Na+)<cd(Na+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com