
����Ŀ��ij�о���ѧϰС������������о�����ˮ��Ӧ���ù������ʵijɷ֡����ʼ���������ʵ��̽��������ͬ����������⣺
̽��һ �����ͼ��ʾװ�ý���������ˮ��Ӧ����ʵ��(�г�������)��
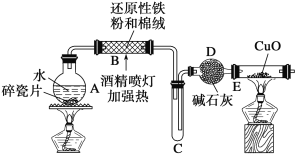
(1)Ӳ�ʲ�����B�з�����Ӧ�Ļ�ѧ����ʽΪ__________________________��
(2)��ӦǰA��Ͷ�����Ƭ��Ŀ����____________________��
(3)װ��E�е�������________________________________��
̽���� �������ʵ�鷽��ȷ����Ӧ��Ӳ�ʲ�����B�к�ɫ����ijɷ֡�
(4)��Ӳ�ʲ�����B��ȴ��ȡ�������еĹ�����������ϡ�����������Һ�ֳ����ݡ�
��һ�ݵμӼ���KSCN��Һ������Һ��Ѫ��ɫ���ƶ�Ӳ�ʲ�����B�й������ʵijɷ�Ϊ________(ѡ����ţ���ͬ)������Һδ��Ѫ��ɫ���ƶ�Ӳ�ʲ�����B�й������ʵijɷ�Ϊ________��
A��һ����Fe3O4 B��һ����Fe C��ֻ��Fe3O4 D��ֻ��Fe
�� ��һ���ý�ͷ�ιܵμ�����KMnO4��Һ������Һ��ɫ������֤����Һ�д��� (�����ӷ���)��
�� �����Լ��У�����ʹFe3��ת��ΪFe2������
A������
B��Fe
C��H2O2
D��ϡ����
E��Cu
���𰸡�(1)3Fe��4H2O(g)![]() Fe3O4��4H2 (2)(1��)��ֹ����
Fe3O4��4H2 (2)(1��)��ֹ����
(3)(1��)��ɫ�����죬�Ҷ˹ܱ���ˮ��
(4)��A �� B �� Fe2+ �� A C D(ȫ��2�֣�©ѡ1�֣���ѡ0��)
��������
�����������̽��һ��(1)Ӳ�ʹ�������ˮ�����ڸ����·�Ӧ������������������������Ӧ�Ļ�ѧ����ʽΪ��3Fe+4H2O(g)![]() Fe3O4+4H2��
Fe3O4+4H2��
(2)Һ�����ʱ�������������������Ƭ�������Ƿ�ֹ���У�
(3)װ��E�з�����ӦΪ��H2+CuO![]() Cu+H2O����Ӧ�����ǣ���ɫ�����죬�Ҷ˹ܱ���ˮ�飻
Cu+H2O����Ӧ�����ǣ���ɫ�����죬�Ҷ˹ܱ���ˮ�飻
��̽������(4)����֤��Ӧ���ɫ����ijɷ�ʱ������Fe3+������Լ�ΪKSCN��Һ����ȷ������Fe3+ʱ������Fe2+����������KMnO4��Һ����������KMnO4��Һ�����ᷢ����Ӧ���������ܽⷴӦ��ĺ�ɫ����ʱ�����������ᣬҲ����������(��ΪHNO3������Fe2+)������ϡ���
��һ�ݵμӼ���KSCN��Һ������Һ��Ѫ��ɫ��˵����Һ�к��������ӣ�����ƶ�Ӳ�ʲ�����B�й������ʵijɷ�Ϊ��A��һ����Fe3O4������Һδ��Ѫ��ɫ������Һ�в����������ӣ����ƶ�Ӳ�ʲ�����B�й���������һ������Fe����B��ȷ���ʴ�ΪAB��
���ý�ͷ�ιܼ������Ը��������Һ�������Ը��������Һ��ɫ����֤����Һ�к����������ӣ�
��Fe3��ת��ΪFe2���Ĺ����ǻ�ԭ���̣���Ҫ���ӻ�ԭ������������H2O2��ϡ���������ǿ�����ԣ�ֻ�ܽ�Fe2������ΪFe3�����ʴ�ΪACD��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2015��8��12����11ʱ�����۹����������������ڻ�ѧΣ��Ʒ�ֿ�������������ը����ֿ�洢��Ͱװ�軯�ƣ���ը���������й©���軯����һ����Ҫ�Ļ�������ԭ�ϣ����ڵ�ơ�ұ��ȣ���˺ܶҵ��ˮ��Ҳ���軯�ƣ��˹�ҵ��ˮ����������ҵ��ˮһͬ��������ͼ�ǹ�ҵ�ϴ���������ˮ�ͺ����ˮ������ͼ��
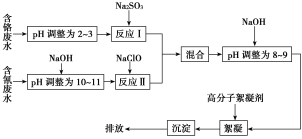
(1)������ˮ�еĸ�Ԫ����Ҫ��CrO![]() ��ʽ���ڣ��ữʱCrO
��ʽ���ڣ��ữʱCrO![]() ��ת��ΪCr2O
��ת��ΪCr2O![]() ��������__________________________��
��������__________________________��
(2)���������£�Cr2O![]() ���ױ���ԭ����ԭΪ���Խ�С��Cr3����ͼ�С���Ӧ�����ӷ���ʽΪ__________________________��
���ױ���ԭ����ԭΪ���Խ�С��Cr3����ͼ�С���Ӧ�����ӷ���ʽΪ__________________________��
(3)���ڱ�ը����ʱ�������軯��ը��������ָ������˫��ˮ������ʹ֮�������������ʣ���֪���߷�Ӧ����һ�ֺ決ʱ���õ����ʣ����ͷų�һ���д̼�����ζ�����壬��������Һ����Һ�����������������д���軯����������ⷴӦ�Ļ�ѧ����ʽ��________________________��
�ڳ�˫��ˮ�⣬��������������ƴ����軯�ƣ�ת��ΪNa2SO3�������Ե�NaSCN��д���������ʷ�����Ӧ�Ļ�ѧ����ʽ��__________________��
(4)pH��10ʱ������Ӧ���е�NaClO�ɽ�������(CN��)��������Ϊ�����������ʣ�д���÷�Ӧ�����ӷ���ʽ��_____________________________��
(5)��������Ӧ�͡���Ӧ�����ַ�ˮ����ϡ���Ŀ����____________________��
���Ϻ����Һ�м�NaOH��Ϊ���Ե�Ŀ����______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͨ�������� �� �� ���ѧʽ��Ϊԭ�ϣ��ۻ���һ��õ������ʣ�д���������������ɲ�����������Ҫ��Ӧ��
��1�� ��
��2�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����5molL��1������10mLϡ�͵�200mL����ȡ��5mL����5mL��Һ�����ʵ���Ũ���ǣ� ��
A.0.05 molL��1
B.0.25 molL��1
C.0.10 molL��1
D.0.50 molL��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)��ͼ��ʾ������������ͨ��ʢ�и�����ɫ�����Ĺ��ƿ��ʢ�г�ʪ��ɫ�����Ĺ��ƿ���ɹ۲쵽�������� ��
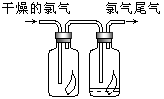
(2)Ϊ��ֹ����β����Ⱦ������������ˮ�����Ե����ʣ����� ��Һ���ն����������ԭ����(�û�ѧ����ʽ��ʾ)______________________________��
(3)������һԭ������ҵ�ϳ������۵�ʯ�������չ�ҵ����β���Ƶ�Ư�ۣ�Ư�۵���Ч�ɷ���__________(�ѧʽ),����¶���ڿ����е�Ư�ۣ���ϡ����������������__________(����ĸ������)��
A��O2 B��H2 C��CO2 D��HClO
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪1 g������ȫȼ������ˮ����ʱ�ų�����121 kJ����������1 mol O=O����ȫ�� ��ʱ��������496 kJ��������1 mol H�DH������ʱ��������Ϊ436 kJ����ˮ������1 mol H�DO���γ�ʱ�ų������� ��
A�� 463kJ B�� 557 kJ C�� 486kJ D��188 kJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijϡ�����ϡ����Ļ����Һ200 mL��ƽ���ֳ����ݣ�������һ��������ͭ�ۣ�������ܽ�19.2 g(��֪����ֻ�ܱ���ԭΪNO����)������һ�����������ۣ�������������������������ӵı仯��ͼ��ʾ�����з��������������( )
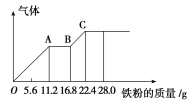
A�������Һ��NO![]() �����ʵ���Ϊ0.4 mol
�����ʵ���Ϊ0.4 mol
B��OA�β�����NO��AB�η�ӦΪ2Fe3����Fe��3Fe2����BC�β�������
C����Һ����������ΪFeSO4
D��c(H2SO4)Ϊ5 mol��L��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ��ʾʵ��װ�õ� K �պ�,�����ж���ȷ����
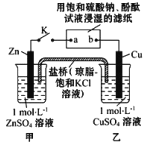
A��Ƭ�̺�׳��� c(SO42-������ B�������� Zn��a��b��Cu ·������
C��Cu �缫�Ϸ�����ԭ��Ӧ D��Ƭ�̺�ɹ۲쵽��ֽ b ����ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����б仯������뻹ԭ������ʵ�ֵ��ǣ� ��
A.H2SO4��SO2
B.H2S��SO2
C.S��SO2
D.SO32����SO2
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com