
【题目】将一定量的Na、Na2O、Na2O2的混合物与足量的水反应,在标准状况下得到a L混合气体。将该混合气体通过电火花引燃,恰好完全反应,则原混合物中Na、Na2O、Na2O2的物质的量之比可能为( )
A. 2:1:2 B. 1:1:2 C. 2:2:1 D. 1:1:1
【答案】C
【解析】
钠与水、过氧化钠与水、氢气与氧气的反应方程式如下:
2Na+2H2O=2NaOH+H2↑,钠与氢气的关系式为2Na~H2;
2Na2O2+2H2O=4NaOH+O2↑,过氧化钠与氧气的关系式为2Na2O2~O2;
2H2+O2![]() 2H2O,氢气和氧气的关系式为2H2~O2。
2H2O,氢气和氧气的关系式为2H2~O2。
将该混合气体通过放电,恰好完全反应,说明氢气和氧气反应的物质的量之比恰好等于它们反应的计量数之比,即氢气和氧气的物质的量之比为2:1,通过钠与氢气、过氧化钠与氧气、氢气与氧气的关系式可得钠与过氧化钠的关系式为:4Na~2H2~O2~2Na2O2,所以钠与过氧化钠的物质的量之比为4:2=2:1,而氧化钠的物质的量不确定,显然只有C中符合钠与过氧化钠的物质的量之比为2:1。
答案选C。


科目:高中化学 来源: 题型:
【题目】某课外小组学生对Cl2与FeBr2溶液反应进行实验探究。
操 作 | 现 象 |
取0.1 mol/L的FeBr2溶液10 mL,测溶液的pH | pH试纸变红(约为4) |
| ⅰ.开始通入100 mL(折合标准状况),溶液由浅绿色逐渐变黄; |
(1)用浓盐酸和MnO2反应制取Cl2的化学方程式是 。
(2)pH≈4的原因是 (用化学用语表示)。
(3)现象i中溶液由浅绿色逐渐变黄。某学生猜测可能原因:①Cl2将Fe2+氧化为Fe3+,使溶液呈黄色;②Cl2将Br-氧化为Br2,使溶液呈黄色。证明原因①的实验方案是 ;证明原因②的实验方案是 。
(4)现象ⅱ中,溶液变为棕黄色。部分学生猜测①:可能是Cl2先将Fe2+氧化生成Fe3+,Cl2又继续氧化Br-生成Br2。部分学生猜测②:可能是Cl2先将Fe2+氧化生成Fe3+,Fe3+将Br-氧化生成Br2。某学生设计实验进行验证,请完成下列表格:
由此实验得出的结论是 。
试管 | 操作 | 现象 | 结论 |
a | 取2 mL FeCl2溶液,滴加少量氯水、2滴KSCN溶液,振荡 |
| Cl2的氧化性强于Fe3+ |
b | 取2 mL FeCl3溶液,滴加少量溴化钠溶液和少量CCl4,振荡 | CCl4层没有明显变化 |
|
c | | CCl4层由无色变为橙黄色 | Cl2的氧化性强于Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液X,由Na+、Mg2+、Ba2+、Al3+、AlO2-、MnO4-、CO32-、SO42-中的若干种离子组成,取溶液进行如下连续实验:

(1)气体A的成分是_______(填化学式,下同) ,气体B的成分是_______。
(2)X溶液中一定存在的离子是______________。
(3)写出步骤①中发生反应的所有离子方程式:______________。
(4)写出步骤②中形成白色沉淀的离子方程式:______________。
(5)通过上述实验,溶液X中不能确定是否存在的离子是______________;只要设计一个简单的后续实验就可以确定该离子是否存在,该方法是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示,室温下的两个连通刚性容器用活塞分开,左右两室体积相同,左室充入一定量NO,右室充入一定量O2,且恰好使两容器内气体密度相同。打开活塞,使NO与O2充分反应且恢复至室温,反应如下:2NO+O2=2NO2。不考虑NO2转化为N2O4,下列判断正确的是
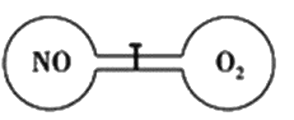
A. 反应前后左室的压强相同
B. 反应后容器内的密度与反应前的相同
C. 开始时左右两室中的分子数相同
D. 反应后容器内无O2存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为氧化铝,含少量氧化铁)制取铝的过程如图所示:

请回答:
(1)试剂1为____________(填化学式),①~④转化过程中____________消耗能量最多;
(2)沉淀B的化学式为__________,该物质除了用于金属冶炼以外,还可用作_____________;
(3)电解F,当转移6mol电子时,可制得铝 _____________g;
(4)生产过程中,除物质E可以循环使用外,还可以循环使用的物质有__________(填化学式);
(5)②中发生反应的离子方程式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取等物质的量浓度的NaOH溶液两份,每份50mL。向其中分别通入一定量的CO2气体,随后各取溶液10mL,并分别加水稀释到100mL。分别向稀溶液后的溶液中逐滴加入0.1mol/L的盐酸,产生CO2气体的体积(标准状况)与所加入的盐酸的体积之间的关系如下图(a)(b)所示。回答下列问题:
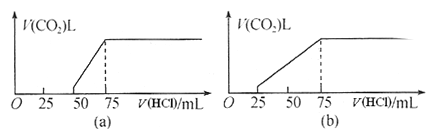
(1)在(a)情况下,溶质为(写化学式)___________,其物质的量之比是__________,标准状况下CO2气体的体积为________。
(2)在(b)情况下,溶质为(写化学式)____________,标准状况下CO2气体的体积为________,原NaOH溶液的物质的量浓度为_________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的两物质相互反应时,若改变反应条件(温度、反应物用量比),化学反应的本质并不改变的是( )
A. Na和O2 B. Cu和硝酸 C. Na2O2和CO2 D. 木炭(C)和O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是
A. 无色透明的溶液中:Fe3+、Mg2+、SCN–、Cl–
B.  =1×1012的溶液中:K+、Na +、CO32-、NO3-
=1×1012的溶液中:K+、Na +、CO32-、NO3-
C. c(Fe2+) =1mol·L1的溶液中:K+、NH4+、MnO4-、SO42-
D. 能使甲基橙变红的溶液中:Na+、NH4+、SO42-、HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.把5.1 g镁铝合金的粉末放入过量的盐酸中,得到5.6 L H2(标准状况下)。
(1)合金中镁的物质的量为_______。
(2)写出该合金溶于足量NaOH溶液的化学方程式:_______。
Ⅱ.在一定质量的AlCl3和MgCl2混合溶液中逐渐滴入一定溶质质量分数的NaOH溶液,生成沉淀的物质的量与加入NaOH的物质的量的关系如图所示。
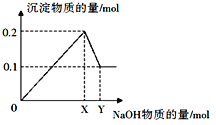
(1)生成Mg(OH)2的质量为__________。
(2)X=_______;Y=_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com