
【题目】某课外小组学生对Cl2与FeBr2溶液反应进行实验探究。
操 作 | 现 象 |
取0.1 mol/L的FeBr2溶液10 mL,测溶液的pH | pH试纸变红(约为4) |
| ⅰ.开始通入100 mL(折合标准状况),溶液由浅绿色逐渐变黄; |
(1)用浓盐酸和MnO2反应制取Cl2的化学方程式是 。
(2)pH≈4的原因是 (用化学用语表示)。
(3)现象i中溶液由浅绿色逐渐变黄。某学生猜测可能原因:①Cl2将Fe2+氧化为Fe3+,使溶液呈黄色;②Cl2将Br-氧化为Br2,使溶液呈黄色。证明原因①的实验方案是 ;证明原因②的实验方案是 。
(4)现象ⅱ中,溶液变为棕黄色。部分学生猜测①:可能是Cl2先将Fe2+氧化生成Fe3+,Cl2又继续氧化Br-生成Br2。部分学生猜测②:可能是Cl2先将Fe2+氧化生成Fe3+,Fe3+将Br-氧化生成Br2。某学生设计实验进行验证,请完成下列表格:
由此实验得出的结论是 。
试管 | 操作 | 现象 | 结论 |
a | 取2 mL FeCl2溶液,滴加少量氯水、2滴KSCN溶液,振荡 |
| Cl2的氧化性强于Fe3+ |
b | 取2 mL FeCl3溶液,滴加少量溴化钠溶液和少量CCl4,振荡 | CCl4层没有明显变化 |
|
c | | CCl4层由无色变为橙黄色 | Cl2的氧化性强于Br2 |
【答案】(1)MnO2+4HCl![]() MnCl2+Cl2↑+2H2O; (1分)
MnCl2+Cl2↑+2H2O; (1分)
(2)Fe2++2H2O![]() Fe(OH)2+2H+ (1分 )
Fe(OH)2+2H+ (1分 )
(3)取少量i中溶液放入试管中,滴加KSCN溶液,若溶液变红,说明①对,否则不成立;(2分)
取5 mL上述黄色溶液于试管中,向其中滴加少量CCl4 ,振荡,若CCl4层呈现橙红色,说明原因②对;否则不成立。 (2分)
(4)a.溶液变成红色(1分)
b.氧化性Fe3+ <Br2或 还原性Fe2+ >Br- (1分)
c.取2 mL 溴化钠溶液,滴加少量氯水和少量CCl4,振荡(1分)
结论:猜测①是正确的。(1分)
【解析】
试题(1)用浓盐酸和MnO2反应制取Cl2的化学方程式是MnO2+4HCl![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
(2)pH≈4的原因是亚铁离子水解使溶液显酸性,离子方程式是Fe2++2H2O![]() Fe(OH)2+2H+
Fe(OH)2+2H+
(3)溶液变成黄色,若①对,溶液中存在Fe3+,取少量i中溶液放入试管中,滴加KSCN溶液,若溶液变红,说明①对,否则不成立;
若②对,溶液中存在溴单质,取5 mL上述黄色溶液于试管中,向其中滴加少量CCl4 ,振荡,若CCl4层呈现橙红色,说明原因②对;否则不成立。
(4)a.Cl2的氧化性强于Fe3+,所以氯气将亚铁离子氧化成Fe3+,滴加KSCN溶液,溶液变红;
b.CCl4层没有明显变化,说明Fe3+不能将Br-氧化生成Br2,结论是氧化性Fe3+ <Br2或 还原性Fe2+ >Br-
c.验证氯气的氧化性强于单质溴氧化性,需进行的操作是取2 mL 溴化钠溶液,滴加少量氯水和少量CCl4,振荡 ; 结论:猜测①是正确的


 互动英语系列答案
互动英语系列答案科目:高中化学 来源: 题型:
【题目】绿矾是含有一定量结晶水的硫酸亚铁(FeSO4·XH2O),在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
(1)在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化。再向试管中通入空气,溶液逐渐变红。由此可知:______________、_______________。
(2)为测定绿矾中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1 g。将样品装入石英玻璃管中,再次将装置A称重,记为 m2 g。按下图连接好装置进行实验。
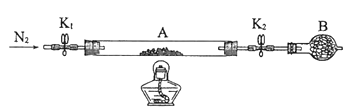
①仪器B的名称是____________________。
②将下列实验操作步骤正确排序___________________(填标号);重复上述操作步骤,直至A恒重,记为m3 g。
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K1和K2
d.打开K1和K2,缓缓通入N2 e.称量A f.冷却至室温
③根据实验记录,计算绿矾化学式中结晶水数目x=________________(列式表示)。若实验时按a、d次序操作,则使x__________(填“偏大”“偏小”或“无影响”)。
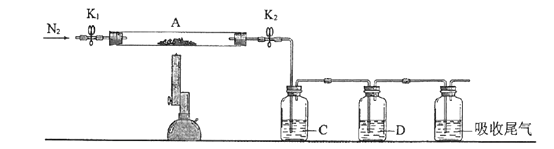
(3)为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A接入下图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。C、D中的溶液依次为BaCl2溶液、浓H2SO4。C、D中有气泡冒出,并可观察到的现象分别为产生白色沉淀、品红溶液褪色。写出硫酸亚铁高温分解反应的化学方程式_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学兴趣小组的同学分别对氯气和氯水的性质进行探究。
Ⅰ.下图是实验室制备氯气并进行一系列相关实验的装置(部分夹持装置已略)。
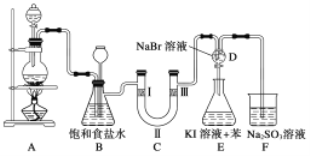
(1)制备氯气选用的药品为二氧化锰和浓盐酸,A中反应的化学方程式为
__________________________________。
(2)装置B中饱和食盐水的作用是______;同时装置B还能监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象______。
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ处最好依次放入________(填序号)。
①干燥的有色布条 ②湿润的有色布条 ③碱石灰④无水氯化钙 ⑤浓硫酸
(4)当向D中缓缓通入一定量氯气时,D中溶液逐渐变为______色;再打开D装置活塞,将装置D中少量溶液滴入锥形瓶E中,振荡,观察到的现象是___________________。
(5)有人提出,装置F中可改用足量的饱和NaHSO3溶液吸收氯气,请判断是否可行________(填“是”或“否”),理由是__________________________________ (用离子反应方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将Cl2缓慢通入水中。当通入的Cl2体积为V1时达到饱和,溶液中c(H+)变化如下图中曲线a。已知Cl2的溶解度随温度升高而迅速降低,下列叙述中正确的是
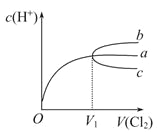
A. 将饱和氯水升温,继续通入Cl2时,溶液中c(H+)变化如曲线b
B. 在饱和氯水中通入SO2气体,溶液中c(H+)变化如曲线c
C. 降温,继续通入Cl2时,溶液中c(H+)增大
D. 在饱和氯水中加入NaOH使pH=7,所得溶液中存在下列关系c(Na+)>c(ClO-)>c(Cl-)>c(HClO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示实验为“套管实验”,小试管内塞有沾有白色无水硫酸铜粉末的棉花球。
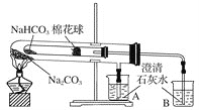
(1)点燃酒精灯加热,能观察到的实验现象是:棉花团变_____色,_____(填A或B)中的石灰水变浑浊
(2)由上述实验你能得出的结论是:Na2CO3的热稳定性_______(填大于或小于) NaHCO3
(3)写出碳酸氢钠受热分解的化学方程式______________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从淡化海水中提取溴的流程如下:

下列有关说法不正确的是
A. X试剂可用Na2SO3饱和溶液
B. 步骤Ⅲ的离子反应:2Br-+Cl2=2Cl-+Br2
C. 工业上每获得1molBr2,需要消耗Cl244.8L
D. 步骤Ⅳ包含萃取、分液和蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有AlCl3和MgSO4混合溶液,向其中不断加入NaOH溶液,得到沉淀的量与加入NaOH溶液的体积如图所示,求原溶液中Cl-与SO42-的物质的量之比为
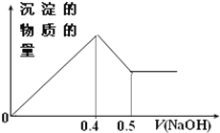
A. 3:1 B. 6:1
C. 2:3 D. 1:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计了如图装置制取和验证SO2的性质。
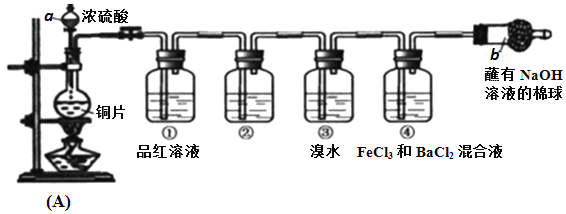
请回答:
(1)写出A反应装置中的化学方程式:____________
(2)棉球中NaOH溶液的作用是________________
(3)为了验证SO2是酸性氧化物,洗气瓶②中可选择的试剂是_________。
A.澄清石灰水 B.无色酚酞试液 C.碘水 D.紫色石蕊试液
(4)下列说法正确的是____________。
A.先向装置中加入试剂(药品),再进行气密性检查
B.实验开始时,只需打开分液漏斗的旋塞,即可使液体顺利滴下
C.实验开始后,洗气瓶①和③中溶液均褪色,两者均可证明SO2具有漂白性
D.实验开始后,洗气瓶④中可观察到白色沉淀产生,该现象可说明SO2具有还原性
(5)写出洗气瓶③中反应的化学方程式:_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的Na、Na2O、Na2O2的混合物与足量的水反应,在标准状况下得到a L混合气体。将该混合气体通过电火花引燃,恰好完全反应,则原混合物中Na、Na2O、Na2O2的物质的量之比可能为( )
A. 2:1:2 B. 1:1:2 C. 2:2:1 D. 1:1:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com