
����Ŀ��һ���¶�������Cl2����ͨ��ˮ�С���ͨ���Cl2���ΪV1ʱ�ﵽ��������Һ��c(H+)�仯����ͼ������a����֪Cl2���ܽ�����¶����߶�Ѹ�ٽ�����������������ȷ����
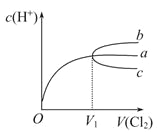
A. ��������ˮ����������ͨ��Cl2ʱ����Һ��c(H+)�仯������b
B. �ڱ�����ˮ��ͨ��SO2��������Һ��c(H+)�仯������c
C. ����������ͨ��Cl2ʱ����Һ��c(H+)����
D. �ڱ�����ˮ�м���NaOHʹpH=7��������Һ�д������й�ϵc(Na+)��c(ClO-)��c(Cl-)��c(HClO)
���𰸡�C
��������
A������ʱ��Cl2���ܽ��Ѹ�ٱ�С����Һ��c(H+)��С��A����
B��SO2����ˮ������Ӧ��Cl2+SO2+2H2O=H2SO4+2HCl����Һ��c(H+)���B����
C�����£�Cl2���ܽ��Ѹ�ٱ����ͨ��Cl2ʱ����Һ��c(H+)����C��ȷ��
D��pH=7ʱ��c(H+)=c(OH-)�����ݵ���غ�ɵ�c(Na+)=c(Cl-)+c(ClO-)����c(Na+)��c(Cl-)��c(Na+)��c(ClO-)������HClO����ȫ���룬��c(Cl-)��c(ClO-)��D����
��ѡC��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����в�������������ԭ�����͵���ʵ�ǣ� ��
A���غ�ɫ��NO2��ѹ����ɫ�ȱ�����dz
B�����������������⻯��������ɵ�ƽ����ϵ��ѹ����ɫ����
C������ɫ����ˮ���պ���ɫ��dz
D���ϳɰ���ҵʹ�ø�ѹ����߰��IJ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
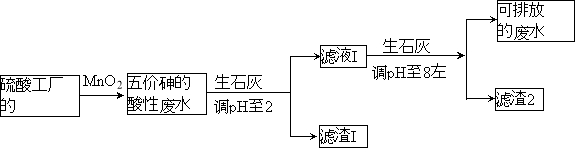
����Ŀ��ij���Ṥ�������Է�ˮ���飨As��Ԫ�غ������ߣ�Ϊ��������ŷţ����û�ѧ���������������ˮ�������������£�
����������±�����ش��������⣺
��1�������ε�Ksp
������ | Ksp |
Ca3(AsO4)2 | 6.8��10��19 |
CaSO4 | 9.1��10��6 |
FeAsO4 | 5.7��10��21 |
��2��������Ⱦ���ŷ�Ũ�ȼ������ŷű�
��Ⱦ�� | H2SO4 | As |
��ˮŨ�� | 29.4g/L | 1.6g��L��1 |
�ŷű� | pH 6��9 | 0.5mg��L��1 |
��1�������Ṥ���ŷŵķ�ˮ����������ʵ���Ũ��c(H2SO4)= mol��L��1��
��2�������Է�ˮ��Fe3+��Ũ��Ϊ1.0��10��4mol��L��1��c(AsO43��)= mol��L��1��
��3�������ŷų������Է�ˮ�е������飨H3AsO3���ᣩ���׳�������Ͷ��MnO2�Ƚ�������������飨H3AsO4���ᣩ��MnO2����ԭΪMn2������Ӧ�����ӷ���ʽΪ ��
��4���ڴ��������ˮʱ���÷ֶ�ʽ�������ˮ��Ͷ����ʯ�ҵ���pH��2����Ͷ����ʯ�ҽ�pH���ڵ�8����ʹ�������Ca3(AsO4)2��ʽ������
����pH���ڵ�2ʱ��ˮ���д�������������������Ҫ�ɷֵĻ�ѧʽΪ ��
��Ca3(AsO4)2��pH���ڵ�8���Ҳſ�ʼ������ԭ��Ϊ
��
�����ᣨH3AsO4���ֲ������ƽ�ⳣ��(25��)Ϊ��K1=5.6��10��3 K2=1.7��10��7 K3=4.0��10��12�������������ƽ�ⳣ���ı���ʽΪK3= ��Na3AsO4�ĵ�һ��ˮ������ӷ���ʽΪ��AsO43��+H2O![]() HAsO42��+OH�����ò�ˮ���ƽ�ⳣ����25����Ϊ�� ��������λ��Ч���֣���
HAsO42��+OH�����ò�ˮ���ƽ�ⳣ����25����Ϊ�� ��������λ��Ч���֣���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ȷ����(����)
A. Һ���ӷ����ڴ��Һ����Լ�ƿ��Ӧ��ˮ��
B. ��ʹ��ʪ�ĵ���KI��ֽ�����ɫ������һ����Cl2
C. ij��Һ����CCl4��CCl4������ɫ��֤��ԭ��Һ�д���I��
D. ij��Һ����BaCl2��Һ������������ϡ����İ�ɫ����������Һһ������Ag��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��700��ʱ�����ݻ�Ϊ2L���ܱ������г���һ������CO��H2O,������Ӧ��CO��g��+ H2O��g��![]() CO2 (g)+ H2��g����Ӧ�����вⶨ�IJ������ݼ��±�������t2>t1��:
CO2 (g)+ H2��g����Ӧ�����вⶨ�IJ������ݼ��±�������t2>t1��:
��Ӧʱ��/min | n��CO��/mol | n(H2O)/mol |
0 | 1.20 | 0.60 |
t1 | 0.80 | |
t2 | 0.20 |
����˵����ȷ���ǣ� ��
A. ��Ӧ��t1min�ڵ�ƽ������Ϊ![]()
B. ���������������䣬��ʼʱ�������г���0.60molCO��1.20 molH2O������ƽ��ʱn(CO2)�� 0.40mol
C. ���������������䣬��ƽ����ϵ����ͨ��0.20molH2O����ԭƽ����ȣ��ﵽ��ƽ��ʱH2Oת��������
D. �¶�����800�棬������Ӧƽ�ⳣ��Ϊ0.64��������ӦΪ���ȷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧ����ʵ��������5��ʵ�飺��ѡ�����ʵ�������ͼ��

��1����AlCl3��Һ����μ���ϡ��ˮֱ�������������������氱ˮ�������ı仯���________
��2����AlCl3��Һ����μ���NaOH��Һֱ��������������������NaOH��Һ�������ı仯���________
��3�������ʯ��ˮ��ͨ��CO2ֱ������������������CO2ͨ�����ı仯���_____
��4����Al2(SO4)3��MgSO4�Ļ����Һ�м���NaOH��Һֱ������������������NaOH��Һ�������ı仯���________
��5����NaOH��Һ����μ���AlCl3��Һ������������������AlCl3�������ı仯���_________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����С��ѧ����Cl2��FeBr2��Һ��Ӧ����ʵ��̽����
�� �� | �� �� |
ȡ0��1 mol/L��FeBr2��Һ10 mL������Һ��pH | pH��ֽ��죨ԼΪ4�� |
| ������ʼͨ��100 mL���ۺϱ�״��������Һ��dz��ɫ��ƣ� |
��1����Ũ�����MnO2��Ӧ��ȡCl2�Ļ�ѧ����ʽ�� ��
��2��pH��4��ԭ���� ���û�ѧ�����ʾ����
��3������i����Һ��dz��ɫ��ơ�ijѧ���²����ԭ����Cl2��Fe2+����ΪFe3+��ʹ��Һ�ʻ�ɫ����Cl2��Br������ΪBr2��ʹ��Һ�ʻ�ɫ��֤��ԭ������ʵ�鷽���� ��֤��ԭ������ʵ�鷽���� ��
��4���������У���Һ��Ϊ�ػ�ɫ������ѧ���²�����������Cl2�Ƚ�Fe2+��������Fe3+��Cl2�ּ�������Br������Br2������ѧ���²�����������Cl2�Ƚ�Fe2+��������Fe3+��Fe3+��Br����������Br2��ijѧ�����ʵ�������֤����������б���
�ɴ�ʵ��ó��Ľ����� ��
�Թ� | ���� | ���� | ���� |
a | ȡ2 mL FeCl2��Һ���μ�������ˮ��2��KSCN��Һ���� |
| Cl2��������ǿ��Fe3+ |
b | ȡ2 mL FeCl3��Һ���μ������廯����Һ������CCl4���� | CCl4��û�����Ա仯 |
|
c | | CCl4������ɫ��Ϊ�Ȼ�ɫ | Cl2��������ǿ��Br2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������;�㷺����Ҫ��������Ӳ�ʻ����µĺϽ��Լ����ݵĵ�˿�������£����ܱ���������H2��ԭWO3�ɵõ������٣����ܷ�ӦΪ��
WO3(s) + 3H2(g)![]() W (s) + 3H2O (g)����ش��������⣺
W (s) + 3H2O (g)����ش��������⣺
��1��������Ӧ�Ļ�ѧƽ�ⳣ������ʽΪ____________________��
��2�� ij�¶��·�Ӧ��ƽ��ʱ��H2��ˮ�����������Ϊ2:3����H2��ƽ��ת����Ϊ___________�����¶ȵ����ߣ�H2��ˮ����������ȼ�С����÷�ӦΪ ��Ӧ��������������������������
��3����H2��ԭWO2Ҳ�ɵõ������١���֪��
WO2(s) + 2H2(g)![]() W (s) + 2H2O (g) ��H =" +66.0" kJ��mol�C1
W (s) + 2H2O (g) ��H =" +66.0" kJ��mol�C1
WO2(g) + 2H2(g)![]() W (s) + 2H2O (g) ��H =��137.9 kJ��mol�C1
W (s) + 2H2O (g) ��H =��137.9 kJ��mol�C1
��WO2(s)![]() WO2(g) ����H = ______________________��
WO2(g) ����H = ______________________��
��4����˿�ƹ��е�W��ʹ�ù����л����ӷ���ʹ��˿��ϸ������I2���ӳ��ƹܵ�ʹ���������乤��ԭ��Ϊ��W (s) +2I2(g)![]() WI4(g)������˵����ȷ����________������ţ���
WI4(g)������˵����ȷ����________������ţ���
a���ƹ��ڵ�I2��ѭ��ʹ�� b��WI4�ڵ�˿�Ϸֽ⣬������W�ֳ����ڵ�˿��
c��WI4�ڵƹܱ��Ϸֽ⣬ʹ�ƹܵ������ӳ�
d���¶�����ʱ��WI4�ķֽ����ʼӿ죬W��I2�Ļ������ʼ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ��ʾ�������µ�������ͨ���������û����ֿ����������������ͬ�����ҳ���һ����NO�����ҳ���һ����O2����ǡ��ʹ�������������ܶ���ͬ��������ʹNO��O2��ַ�Ӧ�һָ������£���Ӧ����:2NO+O2=2NO2��������NO2ת��ΪN2O4�������ж���ȷ����
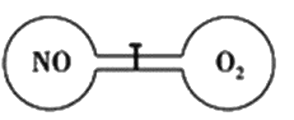
A. ��Ӧǰ�����ҵ�ѹǿ��ͬ
B. ��Ӧ�������ڵ��ܶ��뷴Ӧǰ����ͬ
C. ��ʼʱ���������еķ�������ͬ
D. ��Ӧ����������O2����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com