
【题目】下列对于可逆反应2A(g)+B(g)![]() 2C(g) +3D(g)达到平衡时的说法正确的是
2C(g) +3D(g)达到平衡时的说法正确的是
A. A、B全部转化成了C、DB. 反应已经停止
C. 反应混合物中各组分的浓度不再改变D. v (C)∶v(D)=2∶3
 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案科目:高中化学 来源: 题型:
【题目】已知反应:2NO2(红棕色)![]() N2O4(无色),分别进行如下两个实验:
N2O4(无色),分别进行如下两个实验:
实验ⅰ:将NO2球分别浸泡在热水和冰水中,现象如图1。
实验ⅱ:将一定量的NO2充入注射器中后封口,测定改变注射器体积的过程中气体透光率随时间的变化(气体颜色越深,透光率越小),如图2。下列说法不正确的是
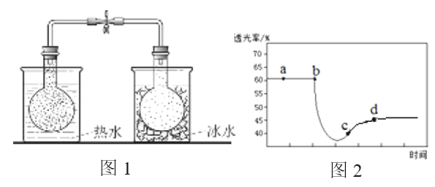
A. 图1现象说明该反应为放热反应
B. 图2中b点的操作是压缩注射器
C. c点:v(正)>v(逆)
D. 若不忽略体系温度变化,且没有能量损失,则T(d)<T(c)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:4NH3+5O2![]() 4NO+6H2O,若反应速率分别用υ(NH3)、υ(O2)、υ(NO)、υ(H2O)[(mol / (L·min)]表示,则正确的关系是( )
4NO+6H2O,若反应速率分别用υ(NH3)、υ(O2)、υ(NO)、υ(H2O)[(mol / (L·min)]表示,则正确的关系是( )
A. 4υ(NH3)=5υ(O2) B. 5υ(O2)=6υ(H2O)
C. 4υ(O2)=5υ(NO) D. 2υ(NH3)=3υ(H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化,下列说法中正确的是
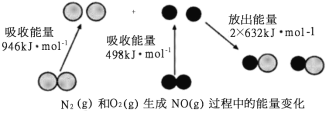
A. 1mol N2(g)和1mol O2(g)完全反应放出的能量为180kJ
B. 通常情况下,N2(g)和O2(g)混合能直接生成NO
C. 1mol N2(g)和1mol O2(g)具有的总能量小于2mol NO(g)具有的总能量
D. NO是一种红棕色的气体,能与水反应生成硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼(Mo)是一种难熔稀有金属,我国的钼储量居世界第二。钼及其合金在冶金,农业、电器、化工、环保等方面有着广泛的应用。
(1)Mo可被发烟硝酸氧化,产物MoOF4和MoO2F2物质的量比为1∶1,完成下列方程式:____Mo+____HF+____HNO3=____ MoO2F2+____ MoOF4+____NO2↑+____ _________
(2)已知:①2Mo(s)+3O2(g)=2MoO3(s) ΔH1
②MoS2(s) +2O2(g)=Mo(s)+2SO2(g) ΔH2
③2MoS2(s)+7O2(g)=2MoO3(s)+4SO2(g) ΔH3
则ΔH3 =_________(用含ΔH1、ΔH2的代数式表示),在反应③中若有0.2mol MoS2参加反应,则转移电子_______________mol。
(3)密闭容器中用Na2CO3(S)作固硫剂,同时用一定量的氢气还原辉钼矿(MoS2)的原理是:MoS2(s)+4H2(g)+2Na2CO3(s)![]() Mo(s)+2CO(g)+4H2O(g)+2Na2S(s) ΔH,实验测得平衡时的有关变化曲线如图所示:
Mo(s)+2CO(g)+4H2O(g)+2Na2S(s) ΔH,实验测得平衡时的有关变化曲线如图所示:

①由图可知,该反应的ΔH__0(填“>”或“<”);P2__________0.1MPa(填“>”或“<”)。
②如果上述反应在体积不变的密闭容器中达平衡,下列说法错误的是______(选填编号)。
A.v正(H2)=v逆(H2O)
B.再加入MoS2,则H2转化率增大
C.容器内气体的密度不变时,一定达平衡状态
D.容器内压强不变时,一定达平衡状态
③由图可知M点时氢气的平衡转化率为____(计算结果保留0.1%)。
④平衡常数可用平衡分压代替平衡浓度计算,气体分压=气体总压×物质的量分数。求图中M点的平衡常数Kp=______(MPa)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为2 L的密闭容器中,由CO2和H2合成甲醇,CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),在其他条件不变的情况下,考察温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300℃);
CH3OH(g)+H2O(g),在其他条件不变的情况下,考察温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300℃);

(1)下列说法正确的是_____________________(填序号);
①温度为T1时,从反应平衡,生成甲醇的平均速率为v(CH3OH)=![]() mol·L-1·min-1
mol·L-1·min-1
②该反应为放热反应
③处于A点的反应体系从T1变到T2,达到平衡时![]() 增大
增大
(2)在T1温度时,将1 mol CO2和3 mol H2充入一密闭恒容容器中,充分反应达到平衡后,若CO2的转化率为α,则容器内的压强与起始压强之比为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是部分短周期元素化合价与原子序数的关系图,下列说法不正确的是( )
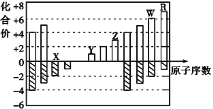
A. 气态氢化物的稳定性:R>W
B. X与Y可以形成原子个数比为1∶1和1∶2的两种离子化合物
C. 由X、Y、Z、W、R五种元素形成的简单离子中半径最小的是X2-
D. Y和Z两者最高价氧化物对应的水化物能相互反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用下列装置(固定及夹持装置、加热仪器和橡胶管略)进行有关氨气制取的实验探究。
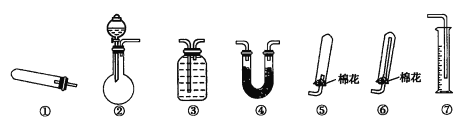
回答下列问题:
(1)若用装置①制取NH3,其反应的化学方程式为__________;若要测定生成的NH3的体积,则必须选择的装置是__________(填装置序号),装置中所盛试剂应具有的性质是__________。
(2)若用装置②制取并收集干燥的NH3,烧瓶内装的试剂是__________,分液漏斗中装的试剂是__________,收集装置应选择__________(填装置序号)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com