
【题目】在甲、乙、丙、丁四个烧杯中分别放入![]() 的钠、氧化钠、过氧化钠和氢氧化钠,然后各加入100mL水,搅拌,使固体全溶解,有甲、乙、丙、丁内溶液的溶质质量分数大小的顺序为( )
的钠、氧化钠、过氧化钠和氢氧化钠,然后各加入100mL水,搅拌,使固体全溶解,有甲、乙、丙、丁内溶液的溶质质量分数大小的顺序为( )
A.甲<乙<丙<丁B.丁<甲<乙=丙C.甲=丁<乙=丙D.丁<甲<乙<丙
【答案】B
【解析】
钠、氧化钠、过氧化钠和水反应的方程式分别如下:
Na+H2O=NaOH+![]() H2↑,溶液增加的质量=m(Na)m(H2)=2.3g0.1g=2.2g,
H2↑,溶液增加的质量=m(Na)m(H2)=2.3g0.1g=2.2g,
Na2O+H2O=2NaOH,溶液增加的质量=m(Na2O)=0.1mol×62g/mol=6.2g;
Na2O2+H2O=2NaOH+![]() O2↑,溶液增加的质量=m(Na2O2)m(O2)=m(Na2O)=6.2g,
O2↑,溶液增加的质量=m(Na2O2)m(O2)=m(Na2O)=6.2g,
将氢氧化钠加入水中,溶液增加的质量为氢氧化钠的质量=0.1mol×40g/mol=4g;
所以溶液增加的质量大小顺序为:钠<氢氧化钠<氧化钠=过氧化钠,
根据钠原子守恒知,0.1mol的钠、氧化钠、过氧化钠、氢氧化钠溶于水所得氢氧化钠的物质的量分别为:0.1mol、0.2mol、0.2mol,0.1mol,
通过以上分析可知,0.1mol的钠、氧化钠、过氧化钠、氢氧化钠分别溶于水所得溶液的质量分数分别为:4g/100g+2.2g×100%、8g/100g+6.2g×100%、8g/100g+6.2g×100%、4g/100g+4g×100%,
所以甲、乙、丙、丁的质量分数大小的顺序是:丁<甲<乙=丙,
答案选B。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】第二代半导体材料——(Ⅲ-V)A族化合物的特殊性能使之成为科学家的研究热点之一。
(1) 基态镓原子的价电子轨道表示式为_____________。
(2) N、P、As位于同一主族,基态氮原子的核外共有________种不同运动状态的电子,N2O的空间构型为_________,NH4NO3中N的杂化方式为_________________,与PO43-互为等电子体的分子有________________(填一种即可)。
(3)已知NH3分子的键角约为107°,而PH3分子的键角约为94°,试用价层电子对互斥理论解释NH3的键角比PH¥的键角大的原因__________________________。
(4)第三周期主族元素中,按第一电离能大小排序,第一电离能在磷和铝之间的元素有________________。
(5)氮化硼、氮化铝、氮化镓的结构类似于金刚石,熔点如表中所示:
物质 | BN | AIN | GaN |
熔点/℃ | 3000 | 2200 | 1700 |
试从结构的角度分析它们熔点不同的原因_____________________。
(6)磷化铝晶胞如图所示,A1原子的配位数为________,若两个铝原子之间的最近距离为d pm,NA代表阿伏加德罗常数的值, 则磷化铝晶体的密度ρ=_________g/cm3。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种常见的金属单质,含A元素的物质灼烧时会发出明亮的黄色火焰;B为紫红色固体,锈蚀时变为绿色;C在空气中加热熔化但不滴落;D在氧气中燃烧,火星四射。根据以上信息回答下列问题:
(1)写出对应化学式:A________,B________,C________,D________。
(2)B锈蚀时生成的绿色物质的主要成分是________,D在氧气中燃烧生成的氧化物为________。
(3)写出下列反应方程式:
①A的碳酸氢盐受热分解的化学方程式______________________________________;
②C单质与烧碱溶液反应的离子方程式______________________________________;
③B与D的三价盐溶液反应的离子方程式____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铬酸钾为原料,电化学法制备重铬酸钾的实验装置示意图如图,下列说法不正确的是( )

A.在阴极室,发生的电极反应为:2H2O+2e-=2OH-+H2↑
B.在阳极室,通电后溶液逐渐由黄色变为橙色,是因为阳极区H+浓度增大,使平衡2CrO42-+2H+![]() Cr2O72-+H2O向右移动
Cr2O72-+H2O向右移动
C.该制备过程总反应的化学方程式为:4K2CrO4+4H2O![]() 2K2Cr2O7+4KOH+2H2↑+O2↑
2K2Cr2O7+4KOH+2H2↑+O2↑
D.测定阳极液中K和Cr的含量,若K与Cr的物质的量之比为d,则此时铬酸钾的转化率为1-0.5d
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家通过测量SiO2中26 Al和10 Be两种元素的比例来确定“北京人”的年龄,这种测量方法叫铝铍测年法。下列关于26 Al和10 Be的说法不正确的是( )
A.5.2g 26 Al3+中所含的电子数约为1.204×1024
B.10 Be和9 Be是中子数不同、质子数相同的不同原子
C.26 Al3+和26 Mg2+的质子数、中子数和核外电子数都不相同
D.10 Be原子核内的中子数比质子数多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学科研小组研究在其他条件不变时,改变某一条件对某类反应[aA(g)+bB(g)cC(g)]的化学平衡的影响,得到图像(图中p表示压强,T表示温度,n表示物质的量,α表示转化率)
反应Ⅰ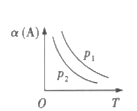 反应Ⅱ
反应Ⅱ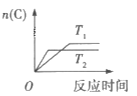
分析图像,回答下列问题:
(1)在反应I中,若![]() >
>![]() ,则该反应的正反应为__________(填“放热”或“吸热”)反应,且为气体分子数__________(填“减小”或“增大”)的反应;若此反应能自发进行,则必须满足的条件是__________
,则该反应的正反应为__________(填“放热”或“吸热”)反应,且为气体分子数__________(填“减小”或“增大”)的反应;若此反应能自发进行,则必须满足的条件是__________
(2)在反应II中,![]() __________(填“>”,“<”或“=”)
__________(填“>”,“<”或“=”)![]() ,该反应的正反应为__________(填“放热”或“吸热”)反应。
,该反应的正反应为__________(填“放热”或“吸热”)反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() 、
、![]() 、
、![]() 、
、![]() 为原子序数依次增大的短周期元素,
为原子序数依次增大的短周期元素,![]() 为地壳中含量最高的过渡金属元素,
为地壳中含量最高的过渡金属元素,![]() 与
与![]() 同主族,
同主族,![]() 与
与![]() 同周期,且
同周期,且![]() 与
与![]() 的原子序数之和为20。甲、乙分别为元素E、A的单质, 丙、丁为A、E分别与B形成的二元化合物,它们转化关系如图所示。下列说法不正确的是( )
的原子序数之和为20。甲、乙分别为元素E、A的单质, 丙、丁为A、E分别与B形成的二元化合物,它们转化关系如图所示。下列说法不正确的是( )
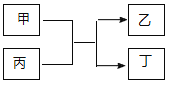
A.![]() 、
、![]() 形成的一种化合物具有漂白性
形成的一种化合物具有漂白性
B.![]() 、
、![]() 形成的离子化合物可能含有非极性键
形成的离子化合物可能含有非极性键
C.![]() 的单质能与丙反应置换出
的单质能与丙反应置换出![]() 的单质
的单质
D.丁为黑色固体,且1mol甲与足量丙反应转移电子3 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气与氧气生成水的反应是氢能源应用的重要途径。下列有关说法正确的是
A. 一定温度下,反应2H2(g)+O2(g) ![]() 2H2O(g)能自发进行,该反应的ΔH<0
2H2O(g)能自发进行,该反应的ΔH<0
B. 氢氧燃料电池的负极反应为O2+2H2O+4e![]() 4OH
4OH
C. 常温常压下,氢氧燃料电池放电过程中消耗11.2 L H2,转移电子的数目为6.02×1023
D. 反应2H2(g)+O2(g) ![]() 2H2O(g)的ΔH可通过下式估算:
2H2O(g)的ΔH可通过下式估算:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知:常温下浓度为0.1mol/L的下列溶液的pH如表
溶质 | NaCl | CH3COOK | Na2CO3 | NaClO | NaHCO3 |
pH | 7 | 8.1 | 11.6 | 9.7 | 8.3 |
①等体积等物质的量浓度的NaCl溶液与NaClO溶液中Cl-和ClO-离子个数:Cl-_________ClO-,浓度相等的NaClO和CH3COOK溶液中:[c(Na+)-c(ClO-)]__________[c(K+)-c(CH3COO-)](填“>”“<”或“=”)
②HCO3-的水解常数为__________(填写具体数值),在相同温度下,同浓度的CH3COOH、H2CO3、HClO三种酸溶液的导电能力大小为__________
(2)常温下,向pH=a的醋酸中加入等体积NaOH时后呈中性,则此NaOH的pH_____14-a(>、<、=)
(3)常温下,已知0.1mol﹒L-1一元酸HA溶液中![]() =1×10-6。
=1×10-6。
①常温下,0.1mol﹒L-1HA溶液的pH=_____;
②pH=3的HA与pH=11的NaOH溶液等体积混合后,溶液中4种离子物质的量浓度大小关系是:_____。
(4)常温下,amol/L氨水与等体积0.1mol/LH2SO4溶液混合后溶液显中性,则NH3·H2O的电离平衡常数Kb=_____
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com