
����Ŀ����A��B��C��D���ֳ����Ľ������ʣ���AԪ�ص���������ʱ�ᷢ�������Ļ�ɫ���棻BΪ�Ϻ�ɫ���壬��ʴʱ��Ϊ��ɫ��C�ڿ����м����ۻ��������䣻D��������ȼ�գ��������䡣����������Ϣ�ش��������⣺
(1)д����Ӧ��ѧʽ��A________��B________��C________��D________��
(2)B��ʴʱ���ɵ���ɫ���ʵ���Ҫ�ɷ���________��D��������ȼ�����ɵ�������Ϊ________��
(3)д�����з�Ӧ����ʽ��
��A��̼���������ȷֽ�Ļ�ѧ����ʽ______________________________________��
��C�������ռ���Һ��Ӧ�����ӷ���ʽ______________________________________��
��B��D����������Һ��Ӧ�����ӷ���ʽ____________________________________��
���𰸡�Na Cu Al Fe Cu2(OH)2CO3 Fe3O4 2NaHCO3![]() Na2CO3+CO2��+H2O 2Al+2OH-+2H2O=2AlO2-+3H2�� Cu+2Fe3+=Cu2++2Fe2+
Na2CO3+CO2��+H2O 2Al+2OH-+2H2O=2AlO2-+3H2�� Cu+2Fe3+=Cu2++2Fe2+
��������
��A��B��C��D���ֳ����Ľ������ʣ���AԪ�ص���������ʱ�ᷢ�������Ļ�ɫ���棬��AΪNa��BΪ�Ϻ�ɫ���壬��ʴʱ��Ϊ��ɫ����BΪCu��C�ڿ����м����ۻ��������䣬CΪAl��D��������ȼ�գ��������䣬��DΪFe��Ȼ��������ʵ����ʼ��仯�������
(1)��������������֪��A��Na��B��Cu��C��Al��D��Fe��
(2)Cu�������ڿ����б�Ϊ��ɫ����Ϊ��ʽ̼��ͭ����ѧʽΪ��Cu2(OH)2CO3��
Fe��������ȼ�գ��������䣬���ɵ�������ΪFe3O4��
(3)��A��̼������NaHCO3���ȶ������ȷֽ⣬����̼���ơ�ˮ��������̼���ֽⷴӦ�Ļ�ѧ����ʽΪ��2NaHCO3![]() Na2CO3+CO2��+H2O��
Na2CO3+CO2��+H2O��
��C��Al��Al�������ռ���Һ��Ӧ����NaAlO2��H2����Ӧ�����ӷ���ʽΪ��2Al+2OH-+2H2O=2AlO2-+3H2����
��Cu���ʾ��л�ԭ�ԣ�Fe3+���������ԣ���������Һ�з���������ԭ��Ӧ������Cu2+��Fe2+����Ӧ�����ӷ���ʽΪ��Cu+2Fe3+=Cu2++2Fe2+��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ʹ�õĽ���֮һ�����������仯������й�֪ʶ���ش��������⣺
(1)�������Ͻ��������еij��ò��ϣ����������У���ȷ������__________��
A������Ӳ�ȱ�������
B��������ʴ��ǿ����������
C������������Ͻ�ֻ������Ԫ��
D������һ�������£�����ˮ������Ӧ
E���������Ũ�����жۻ�
(2)���ˮ����εμ�1 mol��L��1FeCl3��Һ����Һ������ĺ��ɫ���÷�Ӧ�����ӷ���ʽΪ______���γɸ÷�ɢϵ�������ȷ�Χ��_______________��
(3)���ӹ�ҵ����30%��FeCl3��Һ��ʴ���ھ�Ե���ϵ�ͭ������ӡˢ��·�塣��д�� FeCl3��Һ��ͭ��Ӧ�����ӷ���ʽ_____________�����Ӹ�ʴ��ķ�Һ�л���ͭ�����»��FeCl3��Һ�����������Լ��������������ۢ�Ũ�����Ũ������ռ��Ũ��ˮ����Ҫ�õ���һ���Լ���____________��
A���٢ڢ� B���٢ۢܢ�
C���ڢܢ� D���٢ܢ�
(4)��������Na2FeO4 ��һ�����;�ˮ�����ܹ�ɱ������������������Ҫͨ�����·�Ӧ��ȡ��2Fe(OH)3��3NaClO��4NaOH=2Na2FeO4��3X��5H2O����X�Ļ�ѧʽΪ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�춡��ķ��ӽṹ�ɼ�д�ɼ���ʽ�ṹΪ![]() ���л���X�ļ���ʽ�ṹΪ
���л���X�ļ���ʽ�ṹΪ![]() ���л���Y������ʵ�����H2�����ӳɷ�Ӧ�ɵõ��л���X�������й�˵��������ǣ� ��
���л���Y������ʵ�����H2�����ӳɷ�Ӧ�ɵõ��л���X�������й�˵��������ǣ� ��
A. �л���X��һ�ȴ���ֻ��4��
B. ��ϵͳ�����������л���X����Ϊ2��2��3-��������
C. �л���X�ķ���ʽΪC8H18
D. Y�Ľṹ������3�֣�����һ������Ϊ3��4��4-����-2-��ϩ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±��������ʣ��������ǵ���Һ��ͨ��һ����Ӧ��ʵ����ͼ��ʾ��ת������
ѡ�� | X | Y | Z |
|
A | Si | Na2SiO3 | H2SiO3 | |
B | S | H2S | SO2 | |
C | Al2O3 | NaAlO2 | Al2(SO4)3 | |
D | Mg(OH)2 | MgCO3 | MgCl2 |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ��ʵ�����н�����������ʵ�飺��T1Kʱ����2mL0.02mol��L-1������KMnO4��Һ��2mL0.2mol��L-1������Һ��ϣ��۲쵽��Һ��ȫ��ɫ����Ҫ��ʱ����4s;��T2K ʱ����2mL0.03 mol��L-1������KMnO4��Һ��2mL0.2 mol��L-1������Һ��ϣ��۲쵽��Һ��ȫ��ɫ����Ҫ��ʱ����5s������˵����ȷ����
A.ʵ��ٷ�Ӧ���ʽϿ�B.ʵ��ڷ�Ӧ���ʽϿ�
C.���Ƚ϶��߷�Ӧ���ʵĿ���D.T2��������T1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й���������ȷ����( )
A.�ں�![]() ����ԭ�ӵĶ������辧���к���
����ԭ�ӵĶ������辧���к���![]() ��
��![]() ��
��
B.![]() ��
��![]() �ķ��ӽṹ�������������Σ������
�ķ��ӽṹ�������������Σ������![]() ��
��![]() ���ӻ�
���ӻ�![]() �����ж�����
�����ж�����![]() �����ۼ�
�����ۼ�
C.5.6g![]() �뺬0.2mol
�뺬0.2mol![]() ����Һ��ַ�Ӧ������ʧȥ
����Һ��ַ�Ӧ������ʧȥ![]() ������
������
D.![]() ��
��![]() ��ȫˮ����Եõ�
��ȫˮ����Եõ�![]() ��������������
��������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Ҫ����ɱ�������������ȣ��¶���350���������ֽ⡣ijͬѧ��ʵ���������ô�����ȡ����CaO2,��װ��ʾ��ͼ��ͼ:
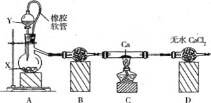
�ش��������⣺
(1)�Ʊ������ķ����ж��֣���X��MnO2,��Y ��____����Y��H2O,��A�з�Ӧ�Ļ�ѧ����ʽΪ__��
(2)ʹ����Ƥ���ܵĺô���_____, B���Լ���______.
(3)ʵ�����ʱ����ͬѧȡ����C�й�������ˮ�У�������һ�ִ̼�����ζ�������Ҹ�������ʯ����Һ����ɫ���������ɷ���_______��
(4)Ϊ������Ʒ�Ĵ��ȣ���ͬѧȷ����8.00g��Ʒ��Ȼ���ܽ���������KI������Һ�У���ַ�Ӧ����ȡ������Һ������һ������0.2000 mol��L-1Na2S2O3��Һ�ζ���I2+2Na2S2O3 =2NaI+Na2S4O6,ָʾ��Ϊ���ۣ����ζ��յ�ʱ������VmL����Һ���жϵζ� �ﵽ�յ�ʱ��������__________����Ʒ��CaO2����Ϊ________����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڼס��ҡ��������ĸ��ձ��зֱ����![]() ���ơ������ơ��������ƺ��������ƣ�Ȼ�������100mLˮ�����裬ʹ����ȫ�ܽ⣬�мס��ҡ�����������Һ����������������С��˳��Ϊ�� ��
���ơ������ơ��������ƺ��������ƣ�Ȼ�������100mLˮ�����裬ʹ����ȫ�ܽ⣬�мס��ҡ�����������Һ����������������С��˳��Ϊ�� ��
A.��<��<��<��B.��<��<��=��C.��=��<��=��D.��<��<��<��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ����
A.��ˮϡ��0.1mol��L��1�İ�ˮ������Һ��![]() ��С
��С
B.pH��3������ʹ���ֱ�������ͬ���¶ȣ�CH3COOH��pH���
C.�ڵ������Ũ�ȵ�����ʹ����зֱ�������������ͬп�������ŷ�Ӧ�Ľ��У�����ϵ����H������Ӧ���ʱ������
D.���ְ�ˮ��pH�ֱ�Ϊa��a��1�����ʵ���Ũ�ȷֱ�Ϊc1��c2����c2<10c1
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com