
【题目】下列叙述正确的是
A.用水稀释0.1mol·L-1的氨水,则溶液中![]() 减小
减小
B.pH=3的盐酸和醋酸分别升高相同的温度,CH3COOH的pH变大
C.在等体积等浓度的盐酸和醋酸中分别加入等质量的相同锌粒,随着反应的进行,醋酸不断电离出H+,反应速率比盐酸大
D.两种氨水的pH分别为a和a+1,物质的量浓度分别为c1和c2,则c2<10c1
【答案】A
【解析】
A. 用水稀释0.1mol·L-1的氨水,促进一水合氨的电离,![]() 减小,
减小,![]() 增大,则溶液中
增大,则溶液中![]() 减小,故A正确;
减小,故A正确;
B. pH=3的盐酸和醋酸分别升高相同的温度,促进醋酸的电离,醋酸溶液中氢离子浓度增大,因此CH3COOH的pH变小,故B错误;
C. 在等体积等浓度的盐酸和醋酸中分别加入等质量的相同锌粒,随着反应的进行,虽然醋酸不断电离出H+,但醋酸中氢离子浓度小于盐酸中,因此反应速率比盐酸小,故C错误;
D. 两种氨水的pH分别为a和a+1,物质的量浓度分别为c1和c2,假设这两者电离程度相同,则c2 = 10c1,根据越弱越电离,物质的量浓度为c1的氨水电离程度大,则浓度应适当小,所以c2 >10c1,故D错误;
综上所述,答案为A。


 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种常见的金属单质,含A元素的物质灼烧时会发出明亮的黄色火焰;B为紫红色固体,锈蚀时变为绿色;C在空气中加热熔化但不滴落;D在氧气中燃烧,火星四射。根据以上信息回答下列问题:
(1)写出对应化学式:A________,B________,C________,D________。
(2)B锈蚀时生成的绿色物质的主要成分是________,D在氧气中燃烧生成的氧化物为________。
(3)写出下列反应方程式:
①A的碳酸氢盐受热分解的化学方程式______________________________________;
②C单质与烧碱溶液反应的离子方程式______________________________________;
③B与D的三价盐溶液反应的离子方程式____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() 、
、![]() 、
、![]() 、
、![]() 为原子序数依次增大的短周期元素,
为原子序数依次增大的短周期元素,![]() 为地壳中含量最高的过渡金属元素,
为地壳中含量最高的过渡金属元素,![]() 与
与![]() 同主族,
同主族,![]() 与
与![]() 同周期,且
同周期,且![]() 与
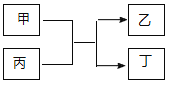
与![]() 的原子序数之和为20。甲、乙分别为元素E、A的单质, 丙、丁为A、E分别与B形成的二元化合物,它们转化关系如图所示。下列说法不正确的是( )
的原子序数之和为20。甲、乙分别为元素E、A的单质, 丙、丁为A、E分别与B形成的二元化合物,它们转化关系如图所示。下列说法不正确的是( )
A.![]() 、
、![]() 形成的一种化合物具有漂白性
形成的一种化合物具有漂白性
B.![]() 、
、![]() 形成的离子化合物可能含有非极性键
形成的离子化合物可能含有非极性键
C.![]() 的单质能与丙反应置换出
的单质能与丙反应置换出![]() 的单质
的单质
D.丁为黑色固体,且1mol甲与足量丙反应转移电子3 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气与氧气生成水的反应是氢能源应用的重要途径。下列有关说法正确的是
A. 一定温度下,反应2H2(g)+O2(g) ![]() 2H2O(g)能自发进行,该反应的ΔH<0
2H2O(g)能自发进行,该反应的ΔH<0
B. 氢氧燃料电池的负极反应为O2+2H2O+4e![]() 4OH
4OH
C. 常温常压下,氢氧燃料电池放电过程中消耗11.2 L H2,转移电子的数目为6.02×1023
D. 反应2H2(g)+O2(g) ![]() 2H2O(g)的ΔH可通过下式估算:
2H2O(g)的ΔH可通过下式估算:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在密闭容器中,能表示反应X(g)+2Y(g)![]() 2Z(g)一定达到化学平衡状态的是( )
2Z(g)一定达到化学平衡状态的是( )
①X、Y、Z的物质的量之比为1∶2∶2
②X、Y、Z的浓度不再发生变化
③容器中的压强不再发生变化
④单位时间内生成n mol Z,同时生成2n mol Y
A.①②B.①④C.②③D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 A、B、C、D、E、F是短周期主族元素,且原子半径依次增大。在短周期中A元素原子半径最小,A与F可形成离子化物FA,C的简单氢化物常用作制冷剂,D、E、F同周期,B、E同主族。回答下列问题:
(1)G是E下一周期同主族元素,G的原子结构示意图为__________。
(2)A与F形成离子化物FA的电子式为___________。
(3)化学家发现一种原子组成比为A4C4的离子化合物,则该化合物的化学式为_______。
(4)C2A4B3是一种常见的炸药,其在常温下撞击时会生成一种气体(C2B)和一种常见液体,该反应的化学方程式为______________。16g该物质反应转移的电子数目为________。
(5)请设计最简单实验说明元素D、E的非金属性强弱:________________________________(简要说明原理和现象即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M、N、X、Y四种物质有如下转化关系(反应条件和其他产物已省略),下列选项不可能的是( )
![]()
A.M:Na X:O2
B.M:HNO3X:Fe
C.M:Al X:NaOH
D.M:NH3X:O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知:常温下浓度为0.1mol/L的下列溶液的pH如表
溶质 | NaCl | CH3COOK | Na2CO3 | NaClO | NaHCO3 |
pH | 7 | 8.1 | 11.6 | 9.7 | 8.3 |
①等体积等物质的量浓度的NaCl溶液与NaClO溶液中Cl-和ClO-离子个数:Cl-_________ClO-,浓度相等的NaClO和CH3COOK溶液中:[c(Na+)-c(ClO-)]__________[c(K+)-c(CH3COO-)](填“>”“<”或“=”)
②HCO3-的水解常数为__________(填写具体数值),在相同温度下,同浓度的CH3COOH、H2CO3、HClO三种酸溶液的导电能力大小为__________
(2)常温下,向pH=a的醋酸中加入等体积NaOH时后呈中性,则此NaOH的pH_____14-a(>、<、=)
(3)常温下,已知0.1mol﹒L-1一元酸HA溶液中![]() =1×10-6。
=1×10-6。
①常温下,0.1mol﹒L-1HA溶液的pH=_____;
②pH=3的HA与pH=11的NaOH溶液等体积混合后,溶液中4种离子物质的量浓度大小关系是:_____。
(4)常温下,amol/L氨水与等体积0.1mol/LH2SO4溶液混合后溶液显中性,则NH3·H2O的电离平衡常数Kb=_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用Na2CO3·10H2O晶体配制0.2mol·L-1Na2CO3溶液230mL。
(1)实验时要用到的玻璃仪器有:除托盘天平、量筒、烧杯、玻璃棒、胶头滴管外,至少还必须用到的一种玻璃仪器是__________,在使用该仪器前必须进行的操作是_______。
(2)应用托盘天平称取Na2CO3·10H2O晶体的质量为___________g。
(3)配制溶液时有多个操作,请简述定容的过程:________。
(4)配制过程中,下列操作会引起所配溶液的浓度偏大的有____(填序号)。
a.Na2CO3·10H2O晶体不纯,混有NaCl
b.用“左码右物”的称量方法称量晶体
c.容量瓶中洗净后未干燥,残留少量水
d.未冷却至室温就转移定容
e.加蒸馏水时不慎超过了刻度线,立即用胶头滴管将多余的水吸出
f.定容时,俯视刻度线
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com