
【题目】铝是一种重要金属,从铝土矿(主要成分为Al2O3 , Fe2O3、SiO2等)中冶炼Al的工业生产流程如下图: 
(1)沉淀B的化学式为 , 溶液A中含的阳离子主要有 .
(2)写出步骤II生成溶液C 的离子方程式 , 步骤I、Ⅱ、Ⅲ都要用到的分离方法是 .
(3)生产过程中,除CaO可以循环使用外,还可以循环使用的物质有:(填化学式).
(4)生产中曾用铝热反应焊接钢轨,则铝与氧化铁发生反应的化学方程式为:
(5)经分析,a吨铝土矿可以冶炼出b吨的铝(假设各生产环节中无损耗),则原铝土矿中Al2O3的纯度(质量分数)(用含a、b的最简式表示).
【答案】
(1)SiO2;Al3+、Fe3+、H+
(2)Al3++4OH﹣=[Al(OH)4]﹣;过滤
(3)CO2、NaOH
(4)2Al+Fe 2O3 ![]() Al 2O3 +2Fe
Al 2O3 +2Fe
(5)![]() ×100%
×100%
【解析】解:由工艺流程可知,铝土矿(主要成分为Al2O3 , Fe2O3、SiO2等),铝土矿与过量的盐酸反应得沉淀B和溶液A,则固体B为SiO2 , 过滤得滤液A含有氯化铝、氯化铁、盐酸等,滤液中加入过量的NaOH,可推知沉淀D为氢氧化铁,过滤得滤液C含有偏铝酸钠、氯化钠,所以向滤液C中通入二氧化碳,生成氢氧化铝沉淀与溶液E为碳酸氢钠或碳酸钠溶液,过滤后向E溶液中加入氧化钙得沉淀G为碳酸钙,同时得到氢氧化钠溶液,氢氧化钠溶液可以循环利用,碳酸钙煅烧分解得氧化钙和二氧化碳都可以循环利用,Al(OH)3灼烧得氧化铝,电解熔融的氧化铝可得铝,(1)根据上面的分析可知,沉淀B的化学式为SiO2 , 溶液A中含的阳离子主要有 Al3+、Fe3+、H+ , 所以答案是:SiO2; Al3+、Fe3+、H+;(2)步骤II过量的氢氧化钠与氯化铝反应生成偏铝酸钠,反应的离子方程式 为Al3++4OH﹣=[Al(OH)4]﹣ , 根据上面的分析可知,步骤I、Ⅱ、Ⅲ都要用到的分离方法是 过滤,所以答案是:Al3++4OH﹣=[Al(OH)4]﹣;过滤;(3)生产过程中,除CaO可以循环使用外,还可以循环使用的物质有CO2、NaOH,所以答案是:CO2、NaOH;(4)铝与氧化铁发生反应的化学方程式为:2Al+Fe 2O3 ![]() Al 2O3 +2Fe, 所以答案是:2Al+Fe 2O3
Al 2O3 +2Fe, 所以答案是:2Al+Fe 2O3 ![]() Al 2O3 +2Fe;(5)a吨铝土矿可以冶炼出b吨的铝,则根据铝元素守恒可知,需要纯氧化铝的质量为
Al 2O3 +2Fe;(5)a吨铝土矿可以冶炼出b吨的铝,则根据铝元素守恒可知,需要纯氧化铝的质量为 ![]() b吨,所以原铝土矿中Al2O3的纯度为
b吨,所以原铝土矿中Al2O3的纯度为 ![]() ×100%=
×100%= ![]() ×100%,所以答案是:
×100%,所以答案是: ![]() ×100%.
×100%.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列仪器能直接用酒精灯加热的是( )
①量筒 ②锥形瓶 ③烧杯 ④试管 ⑤烧瓶 ⑥蒸发皿 ⑦坩埚
A. ②③④⑥⑦ B. ③④⑥⑦ C. ④⑥⑦ D. ②④⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定浓度的盐酸分别与等体积的NaOH溶液和氨水反应,恰好中和,消耗的盐酸体积相同,则NaOH溶液与氨水
A. OH―浓度相等B. pH相等C. 电离度相等D. 物质的量浓度相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验事实与相应结论不正确的是
选项 | 实验事实 | 结论 |
A | 其他条件不变,0.01 mol·L-1的酸性KMnO4溶液分别与0.1 mol·L-1的H2C2O4溶液和0.2 mol·L-1的H2C2O4溶液反应,后者褪色时间短 | 当其他条件不变时,增大反应物浓度可以使化学反应速率加快 |
B | 其他条件不变,分别将等体积、等物质的量浓度的Na2S2O3溶液和H2SO4混合液放在冷水和热水中,放在热水中的混合液先出现浑浊 | 当其他条件不变时,反应体系的温度越高,化学反应速率越快 |
C | 将少量MnO2粉末加入盛有10%双氧水的锥形瓶内,在化学反应前后,MnO2的质量和化学性质都没有发生改变 | 催化剂虽然可以加快化学反应的速率,但一定不参与化学反应过程 |
D | 一定条件下,分别在容积为1 L和容积为2 L的两个密闭容器中加入等量的氢气和碘蒸气,发生如下反应:H2(g)+I2(g) | 当其他条件不变时,气态反应体系的压强越大,化学反应速率越快 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定物质的量的SO2与NaOH溶液反应,所得溶液中含Na2SO3和NaHSO3,若两者物质的量之比为3﹕5,则参加反应的SO2与NaOH的物质的量之比为
A. 3﹕5 B. 1﹕2 C. 18﹕8 D. 8﹕11
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在氯化铁、氯化铜和盐酸的混合溶液中加入铁粉,待反应结束,剩余的固体能被磁铁吸引,则反应后溶液中大量存在的阳离子是
A. Fe2+B. Fe3+C. Cu2+D. H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴及其化合物在磁性材料、电池材料、超硬材料及催化剂等领域有广泛应用.
(1)CoxNi(1-x)Fe2O4可用作H2O2分解的催化剂
①已知CoxNi(1-x)Fe2O4中Co、Ni化合价均为+2,则该化合物这铁元素的化合价为_______
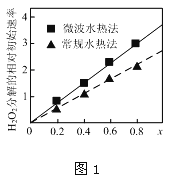
②如图1表示两种不同方法制得的催化剂CoxNi(1-x)Fe2O4在10℃时催化分解6%的H2O2溶液的相对初始速率随x变化曲线.由图中信息可知:_______法制取得到的催化剂活性更高;Co2+、Ni2+两种离子中催化效果更好的是__________
③CoxNi(1-x)Fe2O4能与氢碘酸发生氧化还原反应,所得溶液这含有三种金属离子,写出反应的离子方程式____________
(2)草酸钴是制备钴的氧化物的重要原料。下图2为二水合草酸钴(CoC2O4·2H2O)在空气中受热的质量变化曲线,曲线中300℃及以上所得固体均为钴氧化物。

① 通过计算确定C点剩余固体的化学式为________
② 取一定质量二水合草酸钴分解后的钴氧化物(其中Co的化合价为+2、+3),用480 mL 5 mol/L盐酸恰好完全溶解固体,得到CoCl2溶液和4.48 L(标准状况)黄绿色气体。试确定该钴氧化物中Co、O的物质的量之比为______________。
(3)以硫化钴(Co3S4)为原料冶炼钴的原理为在空气中焙烧矿石得到两种氧化物,反应中只有一种元素被氧化,然后利用铝热反应可得到钴。写出焙烧时的化学方程式:________;写出铝热反应的引发操作_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】检验淀粉、蛋白质、葡萄糖溶液,依次可分别使用的试剂和对应的现象正确的是
A. 碘水,变蓝色 ;浓硝酸,变黄色;新制Cu(OH)2,砖红色沉淀
B. 浓硝酸,变黄色;新制Cu(OH)2,砖红色沉淀;碘水,变蓝色
C. 新制Cu(OH)2,砖红色沉淀;碘水,变蓝色;浓硝酸,变黄色
D. 碘水,变蓝色 ;新制Cu(OH)2,砖红色沉淀;浓硝酸,变黄色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com