
(7分)已知20℃时NaCl的溶解度为36 g。某氯碱厂使用的设备是阳离子交换膜电解槽,若一次向电解槽中加入一定量20℃时饱和NaCl溶液,当90%的NaCl电解时,阴极收集到11. 2 m3气体(已折算成标准状况)。请回答下列问题:
(1)该反应的离子方程式为 。
(2)取阳极区溶液作系列实验,下列结论中错误的是 。(填字母)
A.滴加酚酞试剂,先变红后褪色 B.滴加硝酸银溶液,有白色沉淀产生
C.滴加小苏打溶液,有气泡产生 D.做焰色反应实验呈黄色
(3)计算原饱和NaCl溶液的质量 kg(精确到0.1kg)。
(4)若电解90%的NaCl所需电能是由甲烷燃料电池提供,则所需甲烷至少 m3?
(甲烷的电极反应式:CH4+10OH--8e— = CO32—+7H2O
假设该燃料电池的能量利用率为90%。折算成标准状况。精确至0.1 m3)
(1)2Cl—+2H2O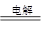 2OH—+Cl2↑+H2↑(2分)
2OH—+Cl2↑+H2↑(2分)
(2)A(2分) (3)245.6 kg(1分) (4)3.1m3(1分)
【解析】(1)惰性电极电解氯化钠溶液,阴极是氢离子放电,阳极是氯离子放电,总反应式为2Cl—+2H2O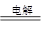 2OH—+Cl2↑+H2↑。
2OH—+Cl2↑+H2↑。
(2)阳极是氯离子放电,生成氯气,氯气溶于水生成次氯酸,显酸性,所以选项A是错误的,不可能变红色。其余选项都是正确的。
(3)设原饱和NaCl溶液的质量是x。阴极收集的气体是氢气,物质的量是500mol,所以被电解的氯化钠是1000mol,质量是58500g。所以有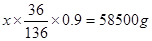 ,解得x=245.6kg。
,解得x=245.6kg。
(4)反应中转移电子是1000mol,所以需要甲烷是1000÷8÷0.9=138.9mol,其体积约是3.1m3。


科目:高中化学 来源: 题型:
| 操作步骤 | 实验现象 | 实验目的 |
| 步骤II:将残留物溶解得到溶液, |
||
| 步骤III: |
||
| 步骤IV:过滤,往滤液中 |
||
| 步骤V:将溶液加热煮沸 |
查看答案和解析>>
科目:高中化学 来源:江西省白鹭洲中学2011-2012学年高二下学期第三次月考化学试题 题型:022
已知20℃时NaCl的溶解度为36 g.某氯碱厂使用的设备是阳离子交换膜电解槽,若一次向电解槽中加入一定量20℃时饱和NaCl溶液,当90%的NaCl电解时,阴极收集到11.2 m3气体(已折算成标准状况).请回答下列问题:
(1)该反应的离子方程式为________.
(2)取阳极区溶液作系列实验,下列结论中错误的是________.(填字母)
A.滴加酚酞试剂,先变红后褪色
B.滴加硝酸银溶液,有白色沉淀产生
C.滴加小苏打溶液,有气泡产生
D.做焰色反应实验呈黄色
(3)计算原饱和NaCl溶液的质量________kg(精确到0.1 kg).
(4)若电解90%的NaCl所需电能是由甲烷燃料电池提供,则所需甲烷至少________m3?
(甲烷的电极反应式:CH4+10OH――8e-=CO32-+7H2O
假设该燃料电池的能量利用率为90%.折算成标准状况.精确至0.1 m3)
查看答案和解析>>
科目:高中化学 来源:2011-2012学年江西省白鹭洲中学高二下学期第三次月考化学试卷(带解析) 题型:填空题
(7分)已知20℃时NaCl的溶解度为36 g。某氯碱厂使用的设备是阳离子交换膜电解槽,若一次向电解槽中加入一定量20℃时饱和NaCl溶液,当90%的NaCl电解时,阴极收集到11. 2 m3气体(已折算成标准状况)。请回答下列问题:
(1)该反应的离子方程式为 。
(2)取阳极区溶液作系列实验,下列结论中错误的是 。(填字母)
| A.滴加酚酞试剂,先变红后褪色 | B.滴加硝酸银溶液,有白色沉淀产生 |
| C.滴加小苏打溶液,有气泡产生 | D.做焰色反应实验呈黄色 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年广东省韶关市高三第一次模拟考试理综化学试卷(解析版) 题型:实验题
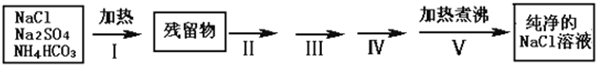
实验室需要纯净的NaCl溶液,但实验室的NaCl晶体混有少量Na2SO4和NH4HCO3,某同学按如下流程图设计实验除去杂质,回答下列问题:

(1)步骤I除去的杂质是(填化学式)_______________,直接加热要好于加强碱后再进行加热,理由是 ;
(2)按流程图完成实验设计,将相关的实验操作、实验现象和实验目的填写在下表中:
|
操作步骤 |
实验现象 |
实验目的 |
|
步骤II:将残留物溶解得到溶液, |
|
|
|
步骤III:
|
|
|
|
步骤IV:过滤,往滤液中
|
|
|
|
步骤V:将溶液加热煮沸 |
|
|
(3)若最后得到20℃的NaCl饱和溶液。已知20℃时NaCl的溶解度为36.0g、NaCl饱和溶液的密度为1.12g/cm3 ,则20℃的NaCl饱和溶液的物质的量浓度为 mol/L(计算结果保留三位有效数字)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com