
【题目】下列离子方程式或电离方程式正确的是( )
A.NaHSO3溶液呈酸性:NaHSO3=Na++H++SO![]()
B.向Na2SiO3溶液中通入少量CO2:SiO![]() +CO2+H2O=H2SiO3↓+CO
+CO2+H2O=H2SiO3↓+CO![]()
C.将一小块钠投入稀醋酸中:2Na+2H+=2Na+H2
D.在Na2S2O3溶液中滴加稀硝酸:2H++S2O![]() =S+SO2+H2O
=S+SO2+H2O
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某地环保部门取一定量某工厂所排废水试样分成甲、乙、丙、丁四份,进行如图所示探究。
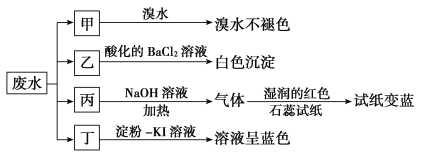
已知废水试样中可能含有下表中的离子:
离子 | |
阳离子 | Na+、Mg2+、X |
阴离子 | Cl-、SO |
请回答下列问题:
(1)离子X是________(填化学式,下同),离子Y是________。
(2)表中不能确定是否存在的阴离子是________,能证明该阴离子是否存在的简单实验操作为_____________________________。
(3)写出废水试样中滴加淀粉KI溶液所发生反应的离子方程式:_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子一定能在指定溶液中大量共存的是( )
A.pH=1的溶液:Ag+、Al3+、Cl-、SO![]()
B.能使酚酞试液变红的溶液:Na+、K+、HCO![]() 、S2-
、S2-
C. ![]() =10-12的溶液:NH
=10-12的溶液:NH![]() 、Cu2+、NO
、Cu2+、NO![]() 、Cl-
、Cl-
D.水电离产生的c(OH-)=10-12mol/L的溶液:K+、Fe2+、SO![]() 、NO
、NO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年8月12日晚11时,天津港国际物流中心区域内化学危险品仓库因起火而发生爆炸。其仓库存储的桶装氰化钠,因爆炸冲击发生了泄漏。氰化钠是一种重要的基本化工原料,用于电镀、冶金等,因此很多工业废水中也含氰化钠,此工业废水可与其他工业废水一同处理。下图是工业上处理含铬废水和含氰废水的流程图:
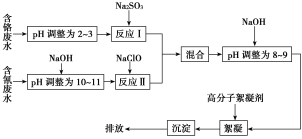
(1)含铬废水中的铬元素主要以CrO![]() 形式存在,酸化时CrO
形式存在,酸化时CrO![]() 可转化为Cr2O
可转化为Cr2O![]() ,现象是__________________________。
,现象是__________________________。
(2)酸性条件下,Cr2O![]() 极易被还原剂还原为毒性较小的Cr3+。图中“反应Ⅰ”的离子方程式为__________________________。
极易被还原剂还原为毒性较小的Cr3+。图中“反应Ⅰ”的离子方程式为__________________________。
(3)①在爆炸发生时有少量氰化钠炸出,有人指出可用双氧水处理,使之被氧化成无毒物质,已知二者反应生成一种烘焙时常用的物质,并释放出一种有刺激性气味的气体,该气体易液化,液化后常用作制冷剂,请写出氰化钠与过氧化氢反应的化学方程式:________________________。
②除双氧水外,还可用硫代硫酸钠处理氰化钠,转化为Na2SO3及弱毒性的NaSCN,写出两种物质发生反应的化学方程式:__________________。
(4)pH>10时,“反应Ⅱ”中的NaClO可将氰离子(CN-)快速氧化为两种无毒的物质,写出该反应的离子方程式:_____________________________。
(5)经过“反应Ⅰ”和“反应Ⅱ”的两种废水“混合”的目的是____________________。
向混合后的溶液中加NaOH调为碱性的目的是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不同固态物质分子1 mol,体积大小并不相同,主要原因是( )
A. 微粒大小不同 B. 微粒质量不同 C. 微粒间平均距离不同 D. 微粒间引力不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在NaCl、MgSO4、 MgCl2这三种盐配成的混合溶液中,若Na+ 的浓度为0.1mol/L、Mg2+的浓度为0.25mol/L、Cl-的浓度为0.2mol/L,则SO42-的物质的量浓度为( )
A.0.5molL-1 B.0.45molL-1 C.0.2molL-1 D.0.25molL-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现象是 。
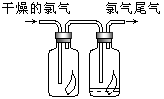
(2)为防止氯气尾气污染空气,根据氯水显酸性的性质,可用 溶液吸收多余的氯气,原理是(用化学方程式表示)______________________________。
(3)根据这一原理,工业上常用廉价的石灰乳吸收工业氯气尾气制得漂白粉,漂白粉的有效成分是__________(填化学式),长期露置于空气中的漂白粉,加稀盐酸后产生的气体是__________(用字母代号填)。
A.O2 B.H2 C.CO2 D.HClO
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com