
【题目】常温下,下列各组离子一定能在指定溶液中大量共存的是( )
A.pH=1的溶液:Ag+、Al3+、Cl-、SO![]()
B.能使酚酞试液变红的溶液:Na+、K+、HCO![]() 、S2-
、S2-
C. ![]() =10-12的溶液:NH
=10-12的溶液:NH![]() 、Cu2+、NO
、Cu2+、NO![]() 、Cl-
、Cl-
D.水电离产生的c(OH-)=10-12mol/L的溶液:K+、Fe2+、SO![]() 、NO
、NO![]()
 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案科目:高中化学 来源: 题型:
【题目】某铝合金中含有合金元素镁、铜、硅,为了测定该合金中铝的含量,设计了如下实验,请回答有关问题:
(1)称取样品a g,称量时应该使用的主要仪器的名称是___________。
(2)将样品溶解于足量的稀盐酸,过滤。滤液中主要含有___________, 滤渣中含有____________,溶解、过滤用到的玻璃仪器是_________________。
(3)滤液中加过量NaOH 溶液、过滤。有关的离子方程式是______________。
(4)步骤(3)中的滤液中通入足量的CO2气体,可产生沉淀,过滤。有关的离子方程式是________________________________________________。
(5)步骤(4)过滤后的滤渣用蒸馏水洗涤数次,烘干并灼烧至恒重,冷却后称量,其质量是b g,原样品中铝的质量分数为____________________。
(6)若步骤(3)中加入NaOH的量不足,则实验结果偏______(填“高”“低”或“无影响”,下同);若步骤(5)中滤渣没有洗涤,则实验结果偏_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 一定条件下可以用H2除去乙烷中混有的乙烯
B. 苯和四氯化碳都能萃取溴水中的溴
C. 乙醇、乙酸和乙酸乙酯三者的混合液可用分液的方法分离
D. 甲烷、乙烯和苯在工业上都可通过石油分馏得到
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式或电离方程式正确的是( )
A.NaHSO3溶液呈酸性:NaHSO3=Na++H++SO![]()
B.向Na2SiO3溶液中通入少量CO2:SiO![]() +CO2+H2O=H2SiO3↓+CO
+CO2+H2O=H2SiO3↓+CO![]()
C.将一小块钠投入稀醋酸中:2Na+2H+=2Na+H2
D.在Na2S2O3溶液中滴加稀硝酸:2H++S2O![]() =S+SO2+H2O
=S+SO2+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物在日常生活中用途比较广泛。
(1)高铁酸钠(Na2FeO4)是一种新型的绿色消毒剂和高容量电池材料。将Fe(NO3)3与NaClO混合后,在碱性条件下发生反应可制得高铁酸钠,该反应的离子方程式为________________________。
(2)四氧化三铁(Fe3O4)常用作颜料、磁流体材料、催化剂和电子材料等。共沉淀法是目前制备纳米Fe3O4的重要方法之一,其流程如图所示:

①为得到较纯净的纳米Fe3O4,FeSO4·7H2O与FeCl3·6H2O的物质的量之比最好为________。但实际操作时,却很难控制这一比例,原因是_____________________________。
②在最佳投料比条件下,检验Fe3O4是否沉淀完全的实验操作是_________________________。
(3)绿矾(FeSO4·7H2O)是治疗缺铁性贫血药品的重要成分。测定绿矾产品中FeSO4·7H2O含量的方法如下:
a.称取3.0 g绿矾产品,配制成250.00 mL溶液;
b.量取25.00 mL a中溶液于锥形瓶中;
c.用0.010 00 mol·L-1酸性KMnO4溶液滴定至终点,消耗KMnO4溶液的平均体积为20.00 mL。滴定时发生反应的离子方程式为5Fe2++MnO![]() +8H+===5Fe3++Mn2++4H2O。
+8H+===5Fe3++Mn2++4H2O。
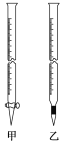
①0.010 00 mol·L-1KMnO4溶液应置于如图所示仪器________(填“甲”或“乙”)中,滴定终点的现象是__________________________________。
②产品中FeSO4·7H2O的质量分数为________(小数点后保留1位数字)。
③若用上述方法测定的样品中FeSO4·7H2O的质量分数偏低(测定过程中产生的误差可忽略),可能的原因有___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式正确的是( )
A. 表示硫的燃烧热的热化学方程式S(s)+![]() O2(g)=SO3(g);ΔH=-315 kJ·mol-1
O2(g)=SO3(g);ΔH=-315 kJ·mol-1
B. 表示中和热的热化学方程式NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l);ΔH=-57.3 kJ·mol-1
C. 表示H2燃烧热的热化学方程式H2(g)+![]() O2(g)=H2O(g);ΔH=-241.8 kJ·mol-1
O2(g)=H2O(g);ΔH=-241.8 kJ·mol-1
D. 表示CO燃烧热的热化学方程式2CO(g)+O2(g)=2CO2(g);ΔH=-566 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外小组用如图装置制取溴苯并证明苯和液溴发生的是取代反应。先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中。
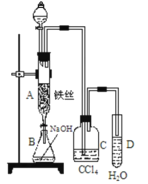
(1)写出 A 中发生反应的化学方程式_____________。
(2)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是__________,写出有关反应的离子方程式____________。
(3)C中盛放 CCl4的作用是___________________。
(4)为证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中加入AgNO3溶液, 若产生淡黄色沉淀,则能证明。另一种验证的方法是向试管D中加入___________,现象是_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com