
【题目】已知酸性:H2SO4>![]() >H2CO3>
>H2CO3>![]() >HCO3—,综合考虑反应物的转化率和原料成本等因素,将
>HCO3—,综合考虑反应物的转化率和原料成本等因素,将 转变为
转变为![]() 的最佳方法是
的最佳方法是
A.与足量的NaOH溶液共热后,再通入足量CO2
B.与足量的NaOH溶液共热后,再加入适量H2SO4
C.与稀H2SO4共热后,加入足量的NaOH溶液
D.与稀H2SO4共热后,加入足量的Na2CO3溶液
科目:高中化学 来源: 题型:
【题目】铬镍基合金的性质稳定,抗高温燃气腐蚀能力强,广泛应用于舰船和工业的燃气轮机。某种铬镍基合金由Fe、Cr、Ni、C四种元素组成。
(1)Fe、Cr、Ni的基态原子核外电子占据的最高能层为________![]() 填符号
填符号![]() 。
。
(2)基态Cr原子价层电子的电子排布式为________,与Cr同周期且基态原子最外层电子数相同的元素,位于周期表的________区。
(3)Fe3+与SCN-反应生成红色的K3Fe(SCN)6,K3Fe(SCN)6内部的作用力有________。写出一种与SCN-互为等电子体的分子的化学式________。
(4)已知FeO、NiO的晶体结构均为NaCl型,且NiO的熔点高于FeO,其理由是________。
(5)C60分子结构及其晶胞结构如图1和图2所示。若在C60晶体的空隙中插入K+,该晶体在一定条件下具有超导能力,其结构如图3所示。

①C60分子中碳原子的杂化方式为________。
②该超导体晶胞中,K+填充在由C60围成的________空隙和________空隙中。
③若晶胞中A的坐标参数为(0,0,0),B的坐标参数为(1,1,1),则与A距离最近的K+的坐标参数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。已知:p(Ba2+)=lgc(Ba2+),p(SO42)=lgc(SO42)。下列说法正确的是
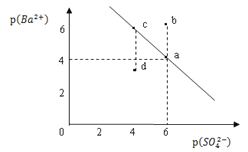
A. 该温度下,Ksp(BaSO4)=1.0×1024
B. 加入BaCl2可以使溶液由c点变到a点
C. d点表示的是该温度下BaSO4的不饱和溶液
D. a点的Ksp(BaSO4)小于b点的Ksp(BaSO4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】牙齿表面由一层硬的、组成为Ca5(PO4)3OH的物质保护着,它在唾液中存在下列溶解平衡:Ca5(PO4)3OH(s)![]() 5Ca2+(aq)+3 PO43—(aq)+OH(aq)。试回答问题:
5Ca2+(aq)+3 PO43—(aq)+OH(aq)。试回答问题:
(1)小孩吃糖后,如果不及时刷牙或漱口,细菌和酶就会作用于糖,在口腔内产生有机羧酸,久而久之,牙齿就会受到腐蚀,其原因是___________。
(2)已知Ca5 (PO4)3F(s)的溶解度比上述矿化产物Ca5(PO4)3OH的溶解度更小,质地更坚硬。当牙膏中配有氟化物添加剂后能防止龋齿,其原因是(用离子方程式和简要文字说明)___________。
(3)根据以上原理,请你提出一种其他促进矿化的方法:_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列叙述的方法中,能将有机化合物 转变为
转变为 的有( )
的有( )
①跟足量NaOH溶液共热后,通入二氧化碳直至过量
②与稀硫酸共热后,加入足量Na2CO3溶液
③与稀硫酸共热后,加入足量NaOH溶液
④与稀硫酸共热后,加入足量NaHCO3溶液
⑤与足量的NaOH溶液共热后,再加入适量H2SO4
A.①②B.②③
C.③④D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五倍子是一种常见的中草药,其有效成分为X,在一定条件下X可分别转化为Y、Z。

下列说法错误的是
A.1 mol Z最多能与7 mol NaOH发生反应
B.1 mol X最多能与2 mol Br2发生取代反应
C.Y分子结构中有3个手性碳原子
D.Y能发生加成、取代、消去、氧化、缩聚反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是
A. 向0.1mol/LCH3COOH溶液中加入少量水,溶液中c(H+)/c(CH3COOH)减小
B. 将CH3COONa溶液从20℃升温至30℃,溶液中c(CH3COO-)/c(CH3COOH)·c(OH-)增大
C. 向盐酸中加入氨水至中性,溶液中c(NH4+)/c(Cl-)>1
D. 向AgCl、AgBr的饱和溶液中加入少量硝酸银,溶液中c(Cl-)/c(Br-)不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列根据反应原理设计的应用,不正确的是
A. CO32-+H2O![]() HCO3-+OH-:用热的纯碱溶液清洗油污
HCO3-+OH-:用热的纯碱溶液清洗油污
B. A13++3H2O![]() Al(OH)3(胶体)+3H+:明矾净水
Al(OH)3(胶体)+3H+:明矾净水
C. TiCl4+(x+2)H2O(过量)![]() TiO2·xH2O↓+4HCl:制备TiO2纳米粉
TiO2·xH2O↓+4HCl:制备TiO2纳米粉
D. SnCl2+H2O![]() Sn( OH)Cl↓+HCl配制氯化亚锡溶液时加入氢氧化钠溶液
Sn( OH)Cl↓+HCl配制氯化亚锡溶液时加入氢氧化钠溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用活性炭还原处理氮氧化物,有关反应为C(s)+2NO(g) ![]() N2(g)+CO2(g)。
N2(g)+CO2(g)。
(1)写出上述反应的平衡常数表达式_______________。
(2)在2L恒容密闭器中加入足量C与NO发生反应,所得数据如表,回答下列问题。
实验编号 | 温度/℃ | 起始时NO的物质的量/mol | 平衡时N2的物质的量/mol |
1 | 700 | 0.40 | 0.09 |
2 | 800 | 0.24 | 0.08 |
①结合表中数据,判断该反应的△H____0(填“>”或“<”),理由是_________。
②判断该反应达到平衡的依据是_______。
A.容器内气体密度恒定 B.容器内各气体浓度恒定
C.容器内压强恒定 D.2v正(NO)= v逆(N2)
(3)700℃时,若向2L体积恒定的密闭容器中充入一定量N2和CO2发生反应:N2(g)+CO2(g)![]() C(s)+2NO(g) ;其中N2、NO物质的量随时间变化的曲线如下图所示。请回答下列问题。
C(s)+2NO(g) ;其中N2、NO物质的量随时间变化的曲线如下图所示。请回答下列问题。

①0~10 min内的CO2平均反应速率v=____________。
②图中A点v(正)___v(逆)(填“>”、“<”或“=”)。
③第10 min时,外界改变的条件可能是_____________。
A.加催化剂 B.增大C的物质的量
C.减小CO2的物质的量 D.升温 E.降温
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com