
【题目】铬镍基合金的性质稳定,抗高温燃气腐蚀能力强,广泛应用于舰船和工业的燃气轮机。某种铬镍基合金由Fe、Cr、Ni、C四种元素组成。
(1)Fe、Cr、Ni的基态原子核外电子占据的最高能层为________![]() 填符号
填符号![]() 。
。
(2)基态Cr原子价层电子的电子排布式为________,与Cr同周期且基态原子最外层电子数相同的元素,位于周期表的________区。
(3)Fe3+与SCN-反应生成红色的K3Fe(SCN)6,K3Fe(SCN)6内部的作用力有________。写出一种与SCN-互为等电子体的分子的化学式________。
(4)已知FeO、NiO的晶体结构均为NaCl型,且NiO的熔点高于FeO,其理由是________。
(5)C60分子结构及其晶胞结构如图1和图2所示。若在C60晶体的空隙中插入K+,该晶体在一定条件下具有超导能力,其结构如图3所示。

①C60分子中碳原子的杂化方式为________。
②该超导体晶胞中,K+填充在由C60围成的________空隙和________空隙中。
③若晶胞中A的坐标参数为(0,0,0),B的坐标参数为(1,1,1),则与A距离最近的K+的坐标参数为________。
【答案】![]() 3d54s1 s、ds 离子键、共价键、配位键 N2O、CO2、CS2、COS(任写一种) Ni2+半径比Fe2+小,NiO的晶格能比FeO大 sp2 正四面体 正八面体 (
3d54s1 s、ds 离子键、共价键、配位键 N2O、CO2、CS2、COS(任写一种) Ni2+半径比Fe2+小,NiO的晶格能比FeO大 sp2 正四面体 正八面体 (![]() ,
,![]() ,
,![]() )
)
【解析】
(1)根据元素原子核外电子层数分析判断;
(2)根据Cr原子核外电子排布式分析判断;
(3)根据K3Fe(SCN)6的结构分析存在的作用力的类型;结合等电子体概念判断;
(4)从离子晶体的晶格能大小分析判断;
(5)①根据价层电子对互斥理论判断C60中C原子杂化方式;
②根据图知,K+占据的是C60围成的正四面体空隙和正八面体空隙;
③若C60分子的原子坐标参数分别为A的坐标参数为(0,0,0),B的坐标参数为(1,1,1),说明该晶胞的棱长是1,则距离A位置C60分子最近的K+为形成的正四面体体心上的分析。
(1)Fe、Cr、Ni的基态原子核外有4个电子层,所以Fe、Cr、Ni的基态原子核外电子占据的最高能层为N层;
(2)Cr元素是24号元素,其原子核外有24个电子,根据构造原理可知其原子的电子排布式为1s22s22p63s23p63d54s1,原子在参加化学反应时,最外层的4s电子及3d轨道上的电子都有可能失去,所以Cr原子的价层电子的电子排布式为:3d54s1;与Cr同周期且基态原子最外层电子数相同的元素有K和Cu,二者分别位于周期表的s区和ds区;
(3)K3Fe(SCN)6内部的作用力有离子键、共价键、配位键;SCN-中含有3个原子,且其价电子数是16,与SCN-互为等电子体的一种分子为N2O、CO2、CS2、COS等;
(4)FeO、NiO的晶体结构均为NaCl型,说明二者都是离子晶体,离子晶体熔沸点与晶格能成正比,晶格能与离子半径成反比,与离子所带电荷成正比,Ni2+半径比Fe2+小,NiO的晶格能比FeO大,所以NiO的熔点高于FeO;
(5)①C60中每个C原子连接3个碳原子,每个C原子形成2个C-C单键、1个C=C双键,C原子杂化轨道数目为3,C原子采取sp2杂化;
②根据图知,该超导体晶胞中,K+占据的是C60围成的正四面体空隙和正八面体空隙;
③若晶胞中A的坐标参数为(0,0,0),B的坐标参数为(1,1,1),说明该晶胞的棱长是1,则与A距离最近的K+位于C60形成的正四面体体心上,故其坐标参数为(![]() ,
,![]() ,
,![]() )。
)。


科目:高中化学 来源: 题型:
【题目】在相同的密闭容器中,用两种不同方法制得的![]() 分别进行催化分解水的实验:
分别进行催化分解水的实验:![]()
![]() ,水蒸气的浓度
,水蒸气的浓度![]() 随时间
随时间![]() 变化如下。
变化如下。
序号 |
| 温度 | 0 | 10 | 20 | 30 | 40 | 50 |
① | 方法I |
|
|
|
|
|
|
|
| p>② | 方法II |
|
|
|
|
|
|
|
③ | 方法II |
|
|
|
|
|
|
|
下列叙述正确的是
A.实验①、②、③的化学平衡常数的关系:![]()
B.实验①比实验②所用的![]() 催化效率高
催化效率高
C.实验的温度:![]()
D.实验①前20min的平均反应速率![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以肉桂酸乙酯 M 为原料,经过相关化学反应合成的抗癌药对治疗乳腺癌有着显著的疗效。已知 M 能发生如下转化:

已知:C的结构简式为![]() ,请回答下列问题:
,请回答下列问题:
(1)A 的结构简式为_____,E 中官能团的名称是_____。
(2)写出反应③和⑥的化学方程式: _____。
(3)在合适的催化剂作用下,由 E 可以制备高分子化合物 H,H 的结构简式为_____,由 E 到 H的反应类型为_____。
(4)Ⅰ是 B 的同分异构体,且核磁共振氢谱中只有一组吸收峰,Ⅰ的结构简式为_____。
(5)A 的同分异构体有多种,其中属于芳香族化合物,既能使溴的四氯化碳溶液褪色,又能与碳酸氢钠溶液反应的同分异构体有_____种(不包含 A)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有五种化合物是分别由以下原子![]() 团
团![]() 中的两种不同的原子
中的两种不同的原子![]() 团
团![]() 组成的:
组成的:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 。已知A是一种能发生银镜反应的酸,它跟B在一定条件下可生成C和
。已知A是一种能发生银镜反应的酸,它跟B在一定条件下可生成C和![]() ,C是D的同分异构体,E可在碱性条件下和
,C是D的同分异构体,E可在碱性条件下和![]() 反应生成B。按要求回答问题
反应生成B。按要求回答问题![]() 提示:所有物质所含碳原子均不超过两个,以上基团可以重复使用
提示:所有物质所含碳原子均不超过两个,以上基团可以重复使用![]()
(1)C的结构简式__________;
(2)A与D的关系______________________![]() 填序号
填序号![]() ;
;
①同系物 ②同分异构体 ③同种物质 ④同位素 ⑤同素异形体
(3)请写出相对分子质量与D相等且属于饱和一元醇的所有同分异构体的结构简式______;
(4)请写出下列反应的方程式:![]() 转化的离子方程式:_____________;C与氢氧化钠水溶液反应的化学方程式:_________。
转化的离子方程式:_____________;C与氢氧化钠水溶液反应的化学方程式:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】测定0.1 mol·L-1 Na2SO3溶液先升温再降温过程中的pH,数据如下。
时刻 | ① | ② | ③ | ④ |
温度/℃ | 25 | 30 | 40 | 25 |
pH | 9.66 | 9.52 | 9.37 | 9.25 |
实验过程中,取①④时刻的溶液,加入盐酸酸化的BaCl2溶液做对比实验,④产生白色沉淀多。
下列说法不正确的是
A. Na2SO3溶液中存在水解平衡:![]() +H2O
+H2O![]()
![]() +OH
+OH
B. ④的pH与①不同,是由于![]() 浓度减小造成的
浓度减小造成的
C. ①→③的过程中,温度和浓度对水解平衡移动方向的影响一致
D. ①与④的Kw值相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某密闭容器中充入一定量N2、H2发生反应N2(g)+3H2(g)![]() 2NH3(g),测得NH3浓度与反应温度关系如图。下列说法正确的是( )
2NH3(g),测得NH3浓度与反应温度关系如图。下列说法正确的是( )
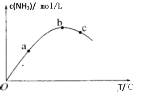
A.该反应△H>0
B.N2转化率:c>b>a
C.化学反应速率:c>b>a
D.平衡常数K:b>c>a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示溶液中c(H+)和c(OH-)的关系,下列判断错误的是
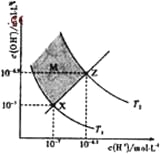
A. 两条曲线间任意点均有c(H+)×c(OH-)=Kw
B. M区域内任意点均有c(H+)<c(OH-)
C. 图中T1<T2
D. XZ线上任意点均有pH=7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物说法正确的是
A. 有机物![]() 的名称是2,3,5,5-四甲基-4-乙基己烷
的名称是2,3,5,5-四甲基-4-乙基己烷
B. 乙酸乙酯在碱性条件下的水解反应称为皂化反应
C. 有机物![]() 中可能共面的原于数最多有17个
中可能共面的原于数最多有17个
D. 乙醛和丙烯醛(![]() )不是同系物,分别与足量H2反应后的产物也不是同系物
)不是同系物,分别与足量H2反应后的产物也不是同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知酸性:H2SO4>![]() >H2CO3>
>H2CO3>![]() >HCO3—,综合考虑反应物的转化率和原料成本等因素,将
>HCO3—,综合考虑反应物的转化率和原料成本等因素,将 转变为
转变为![]() 的最佳方法是
的最佳方法是
A.与足量的NaOH溶液共热后,再通入足量CO2
B.与足量的NaOH溶液共热后,再加入适量H2SO4
C.与稀H2SO4共热后,加入足量的NaOH溶液
D.与稀H2SO4共热后,加入足量的Na2CO3溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com