
【题目】有五种化合物是分别由以下原子![]() 团
团![]() 中的两种不同的原子
中的两种不同的原子![]() 团
团![]() 组成的:
组成的:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 。已知A是一种能发生银镜反应的酸,它跟B在一定条件下可生成C和
。已知A是一种能发生银镜反应的酸,它跟B在一定条件下可生成C和![]() ,C是D的同分异构体,E可在碱性条件下和
,C是D的同分异构体,E可在碱性条件下和![]() 反应生成B。按要求回答问题
反应生成B。按要求回答问题![]() 提示:所有物质所含碳原子均不超过两个,以上基团可以重复使用
提示:所有物质所含碳原子均不超过两个,以上基团可以重复使用![]()
(1)C的结构简式__________;
(2)A与D的关系______________________![]() 填序号
填序号![]() ;
;
①同系物 ②同分异构体 ③同种物质 ④同位素 ⑤同素异形体
(3)请写出相对分子质量与D相等且属于饱和一元醇的所有同分异构体的结构简式______;
(4)请写出下列反应的方程式:![]() 转化的离子方程式:_____________;C与氢氧化钠水溶液反应的化学方程式:_________。
转化的离子方程式:_____________;C与氢氧化钠水溶液反应的化学方程式:_________。
【答案】HCOOCH3 ① CH3CH2CH2OH或CH3CHOHCH3 CH3Br+OH-![]() CH3OH+Br- HCOOCH3+NaOH→HCOONa+CH3OH
CH3OH+Br- HCOOCH3+NaOH→HCOONa+CH3OH
【解析】
A是一种能发生银镜反应的酸,说含有醛基和羧基,A为甲酸;它跟B在一定条件下可生成C和H2O,说明B为醇,C为酯,则B中含有羟基只能为CH3OH,A和B在一定条件下可生成HCOOCH3和H2O,C为HCOOCH3,C是D的同分异构体,则D为CH3COOH;E可在碱性条件下和H2O反应生成B,则E为CH3Br,据此分析解答。
根据上述分析,A为HCOOH,B为CH3OH,C为HCOOCH3,D为CH3COOH,E为CH3Br。
(1)C为HCOOCH3,故答案为:HCOOCH3;
(2)A为HCOOH,D为CH3COOH,结构相似,分子组成上相差1个CH2,互为同系物,故答案为:①;
(3)D为乙酸,相对分子质量相等的醇为C3H7OH,同分异构体的结构简式有:CH3CH2CH2OH或CH3CHOHCH3,故答案为:CH3CH2CH2OH或CH3CHOHCH3;
(4)CH3Br→CH3OH转化的离子方程式:CH3Br+OH-![]() CH3OH+Br-;HCOOCH3与氢氧化钠水溶液反应的化学方程式:HCOOCH3+NaOH→HCOONa+CH3OH,故答案为:CH3Br+OH-
CH3OH+Br-;HCOOCH3与氢氧化钠水溶液反应的化学方程式:HCOOCH3+NaOH→HCOONa+CH3OH,故答案为:CH3Br+OH-![]() CH3OH+Br-;HCOOCH3+NaOH→HCOONa+CH3OH。
CH3OH+Br-;HCOOCH3+NaOH→HCOONa+CH3OH。


科目:高中化学 来源: 题型:
【题目】某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
(实验原理)2KMnO4 + 5H2C2O4 + 3H2SO4= K2SO4 + 2MnSO4 + 10CO2↑ + 8H2O
(实验内容及记录)
实验编号 | 室温下,试管中所加试剂及其用量 / mL | 室温下溶液颜色褪至无色所需时间 / min | |||
0.6 mol/L H2C2O4溶液 | H2O | 3 mol/L 稀硫酸 | 0.05mol/L KMnO4溶液 | ||
1 | 3.0 | 2.0 | 2.0 | 3.0 | 1.5 |
2 | 2.0 | 3.0 | 2.0 | V1 | 2.7 |
3 | 1.0 | V2 | 2.0 | 3.0 | 3.9 |
请回答:(1)表中V1=___________,V2=___________。
(2)根据上表中的实验数据,可以得到的结论是_____________________________。
(3)利用实验1中数据计算,若用KMnO4的浓度变化表示的反应速率为:υ(KMnO4)= ________________________。
(4)该小组同学根据经验绘制了n(Mn2+) 随时间变化趋势的示意图,如图1所示。但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+) 随时间变化的趋势应如图2所示。该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究。(忽略反应过程中温度变化)
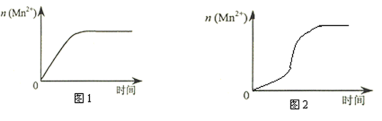
①该小组同学提出的假设是_______________________________________。
②请你帮助该小组同学完成实验方案。
实验编号 | 室温下,试管中所加试剂及其用量 / mL | 再向试管中加入少量固体 | 室温下溶液颜色褪至无色所需时间 / min | |||
0.6 mol/L H2C2O4溶液 | H2O | 3 mol/L 稀硫酸 | 0.05 mol/L KMnO4溶液 | |||
4 | 3.0 | 2.0 | 2.0 | 3.0 | A | t |
表中加入的固体A是_______________。(写化学式)
③若该小组同学提出的假设成立,应观察到的现象是____________
(5)工业上可用电解K2MnO4溶液的方法制取KMnO4,则电解时,阳极发生的电极反应式为____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向容积固定为2L的密闭容器中充入![]() 和
和![]() ,发生如下反应:①
,发生如下反应:①![]()
![]() ②
②![]() 测得
测得![]() 和
和![]() 的浓度变化如图所示,
的浓度变化如图所示,![]() 维持容器温度为
维持容器温度为![]() ,10min时改变某反应条件,一段时间后再次平衡。下列说法正确的是
,10min时改变某反应条件,一段时间后再次平衡。下列说法正确的是![]()
![]()
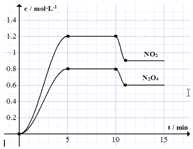
A.前5min反应的平均速率![]()
B.![]() 时反应①的化学平衡常数
时反应①的化学平衡常数![]()
C.10min时改变反应条件可能是降低温度
D.若起始时向该容器中充入![]() 和
和![]() ,
,![]() 达到平衡时,
达到平衡时,![]() 的物质的量浓度与图中
的物质的量浓度与图中![]() 的不同
的不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】测定0.1 mol·L-1 Na2SO3溶液先升温再降温过程中的pH,数据如下。
时刻 | ① | ② | ③ | ④ |
温度/℃ | 25 | 30 | 40 | 25 |
pH | 9.66 | 9.52 | 9.37 | 9.25 |
实验过程中,取①④时刻的溶液,加入盐酸酸化的BaCl2溶液做对比实验,④产生白色沉淀多。
下列说法不正确的是
A. Na2SO3溶液中存在水解平衡:![]() +H2O
+H2O![]()
![]() +OH
+OH
B. ④的pH与①不同,是由于![]() 浓度减小造成的
浓度减小造成的
C. ①→③的过程中,温度和浓度对水解平衡移动方向的影响一致
D. ①与④的Kw值相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有甲、乙两种物质:甲![]() 、乙
、乙![]() 。由甲转化为乙需经下列过程
。由甲转化为乙需经下列过程![]() 已略去各步反应的无关产物,下同
已略去各步反应的无关产物,下同![]()
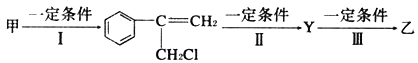
①反应I的反应类型是__________,反应II的条件是___________,反应III的化学方程式为_________________________
②下列物质不能与乙反应的是_________![]() 填序号
填序号![]() 。
。
![]() 金属钠
金属钠 ![]() 溴水
溴水 ![]() 氢氧化钠溶液
氢氧化钠溶液 ![]() 乙酸
乙酸
(2)写出苯酚和碳酸钠溶液反应的离子方程式__________________。
(3)写出乙醛和银氨溶液反应的化学方程式____________________。
(4)写出乙二酸和钠反应的化学方程式______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向20mL0.1mol/LNaOH溶液中逐滴加入0.1mol/L![]() 溶液,溶液的pH与所加
溶液,溶液的pH与所加![]() 溶液的体积关系如图所示,下列说法正确的是
溶液的体积关系如图所示,下列说法正确的是

A.进行该实验时,温度高于![]()
B.a点溶液中:![]()
C.c点溶液中:![]()
D.![]() 过程中,水的电离程度始终逐渐增大
过程中,水的电离程度始终逐渐增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬镍基合金的性质稳定,抗高温燃气腐蚀能力强,广泛应用于舰船和工业的燃气轮机。某种铬镍基合金由Fe、Cr、Ni、C四种元素组成。
(1)Fe、Cr、Ni的基态原子核外电子占据的最高能层为________![]() 填符号
填符号![]() 。
。
(2)基态Cr原子价层电子的电子排布式为________,与Cr同周期且基态原子最外层电子数相同的元素,位于周期表的________区。
(3)Fe3+与SCN-反应生成红色的K3Fe(SCN)6,K3Fe(SCN)6内部的作用力有________。写出一种与SCN-互为等电子体的分子的化学式________。
(4)已知FeO、NiO的晶体结构均为NaCl型,且NiO的熔点高于FeO,其理由是________。
(5)C60分子结构及其晶胞结构如图1和图2所示。若在C60晶体的空隙中插入K+,该晶体在一定条件下具有超导能力,其结构如图3所示。

①C60分子中碳原子的杂化方式为________。
②该超导体晶胞中,K+填充在由C60围成的________空隙和________空隙中。
③若晶胞中A的坐标参数为(0,0,0),B的坐标参数为(1,1,1),则与A距离最近的K+的坐标参数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究晶体的结构对化学新材料的发现有着重要的价值。
(1)晶胞中任一个原子的中心位置均可用称之为原子分数坐标的三个分别小于1的数(x,y,z)来予以规定。某晶体的晶胞结构如图所示,1号原子坐标为(0,0,0),2号原子坐标为(1/3,2/3,0),该晶体的化学式为___________,该晶胞参数为:a = 250.4 pm, c = 666.1 pm,γ = 120o; 3号原子坐标为_____________,列出上述晶体中A和B两原子间的最小核间距的计算式为_____________。(不必算出数值,但需要化简)

(2)体心立方堆积的晶胞是个立方体,如果半径为r的原子保持紧密接触,立方体的中心能容得下半径最大为___________的一个原子。
(3)Fe能形成多种氧化物,其中FeO晶胞结构为NaCl型。晶体中实际上存在空位、错位、杂质原子等缺陷,晶体缺陷对晶体的性质会产生重大影响。由于晶体缺陷,在晶体中Fe和O的个数比发生了变化,变为FexO(x<1),若测得某FexO晶体密度为5.71 g·cm-3,晶胞边长为4.28×10-10 m,则FexO中x=__________(结果保留两位有效数字)。
(4)钙钛矿晶体的结构如图所示。假设把氧离子看做硬球接触模型,钙离子和钛离子填充氧离子的空隙,氧离子形成正八面体,钛离子位于正八面体中心,则一个钛离子被__________个氧离子包围;钙离子位于立方晶胞的体心,一个钙离子被_____个氧离子包围。钙钛矿晶体的化学式为__________。若氧离子半径为a pm,则钙钛矿晶体中两个钛离子间最短距离为_______pm,钛离子与钙离子间最短距离为_______pm。

(5)钛元素有两种同素异形体,常温下是六方堆积,高温下是体心立方堆积。如图所示F晶体的结构中,晶胞参数a=0.295nm,c=0.469nm,则该F晶体的密度为_____________ g· cm-3
(用NA表示阿伏加德罗常数的值,列出计算式即可,不用化简)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】牙齿表面由一层硬的、组成为Ca5(PO4)3OH的物质保护着,它在唾液中存在下列溶解平衡:Ca5(PO4)3OH(s)![]() 5Ca2+(aq)+3 PO43—(aq)+OH(aq)。试回答问题:
5Ca2+(aq)+3 PO43—(aq)+OH(aq)。试回答问题:
(1)小孩吃糖后,如果不及时刷牙或漱口,细菌和酶就会作用于糖,在口腔内产生有机羧酸,久而久之,牙齿就会受到腐蚀,其原因是___________。
(2)已知Ca5 (PO4)3F(s)的溶解度比上述矿化产物Ca5(PO4)3OH的溶解度更小,质地更坚硬。当牙膏中配有氟化物添加剂后能防止龋齿,其原因是(用离子方程式和简要文字说明)___________。
(3)根据以上原理,请你提出一种其他促进矿化的方法:_________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com