
【题目】某温度下,向20mL0.1mol/LNaOH溶液中逐滴加入0.1mol/L![]() 溶液,溶液的pH与所加
溶液,溶液的pH与所加![]() 溶液的体积关系如图所示,下列说法正确的是
溶液的体积关系如图所示,下列说法正确的是

A.进行该实验时,温度高于![]()
B.a点溶液中:![]()
C.c点溶液中:![]()
D.![]() 过程中,水的电离程度始终逐渐增大
过程中,水的电离程度始终逐渐增大
 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化学 来源: 题型:
【题目】在一定条件下,由CO2与H2反应可合成甲醇,反应为CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g);如图所示为向一固定容积为2 L的绝热密闭容器中加入1 mol CH3OH和1 mol H2O后,反应体系内CO2浓度的变化;其中第5 min 时,在其他条件不变的条件下,向容器中加入一定物质的量的 CO2和H2,第8 min 重新达到平衡状态,此时反应体系内c(H2)=c(CH3OH)。下列说法错误的是
CH3OH(g)+H2O(g);如图所示为向一固定容积为2 L的绝热密闭容器中加入1 mol CH3OH和1 mol H2O后,反应体系内CO2浓度的变化;其中第5 min 时,在其他条件不变的条件下,向容器中加入一定物质的量的 CO2和H2,第8 min 重新达到平衡状态,此时反应体系内c(H2)=c(CH3OH)。下列说法错误的是

A. 0~4 min 内,生成CO2的平均反应速率为0.025 mol·L-1·min-1
B. 第5 min 时在反应容器中加入了0.20 mol CO2和0.40 mol H2
C. 8 min后CH3OH的平衡浓度为0.425 mol·L-1
D. 前5 min CH3OH的转化率为20%,5~8 min H2的转化率为37.5%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组探究元素周期律性质递变规律,设计如下实验。

实验I:验证碳、氮、硅元素非金属性强弱。(供选择的试剂:稀HNO3、浓H2SO4、CaCO3固体、Na2CO3固体、Na2SiO3溶液、澄清石灰水、饱和NaHCO3溶液)
(1)仪器a的名称:____。装置B所盛试剂是_____,其作用是_____;C中反应的离子方程式是_____________。
(2)通过实验证明碳、氮、硅的非金属性由强到弱的顺序是_____。
实验II:验证同周期元素和同主族元素的金属性递变规律。(方案与现象不对应)
实验方案:①将一小块金属钠放入滴有酚酞试液的冷水中
②将一小块金属钾放入滴有酚酞试液的冷水中
③镁带与2 mol·L-1的盐酸反应
④铝条与2 mol·L-1的盐酸反应
⑤用砂纸擦后的镁带与沸水反应再向反应液中滴加酚酞
实验现象: A.浮在水面上,熔成小球,四处游动,随后消失,溶液变成红色
B.浮在水面上,熔成小球,四处游动,并伴有轻微的爆炸声,很快消失,溶液变成红色
C.产生气体,可在空气中燃烧,溶液变成浅红色
D.反应不十分剧烈,产生气体可以在空气中燃烧
E.剧烈反应,产生的气体可以在空气中燃烧
请回答:
(1)该实验中用到的玻璃仪器有____、______胶头滴管玻璃片、试管。
(2)请完成下列表格
实验方案 | 实验现象 | 化学方程式 |
① | A | 2Na +2H2O=2NaOH +H2↑ |
② | ____ | ____ |
③ | E | Mg +2HCl=MgCl2 +H2↑ |
④ | D | 2Al +6HC1=2AlCl3 +H2↑ |
⑤ | ____ | ____ |
(3)由实验得出有关元素周期律结论:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制备锌印刷电路板是用稀硝酸腐蚀锌板产生的废液称“烂板液”。“烂板液”中除含硝酸锌外,还含有自来水带入的Cl-和Fe3+,在实验室里,用“烂板液”制取ZnSO47HO的过程如图所示:

(1)若稀硝酸腐蚀锌板时还原产物为N2O,氧化剂与还原剂的物质的量之比是___。
(2)若步骤①的pH>12,则Zn(OH) 2溶解生成偏锌酸钠(Na2ZnO2),Zn(OH) 2溶解的离子方程式为___。
(3)滤液D中除了含有OH-离子外,还含有的阴离子有___(填离子符号)。
(4)25℃时,若滤液E的pH=4,c(Zn2+)=2mol·L1,(Fe3+)=2.6×10-9mo·L1试求出Fe(OH)3的溶度积常数___(只写结果)。
(5)已知:①Fe(OH)3(s)![]() Fe3+(aq)+3OH-(aq) H=a kJ mol·L1
Fe3+(aq)+3OH-(aq) H=a kJ mol·L1
②H2O(l)![]() H+(aq)+OH-(aq) H=bkJ·mol·L1
H+(aq)+OH-(aq) H=bkJ·mol·L1
请写出Fe3+发生水解反应的热化学方程式:___。
若①的溶度积常数为Ksp,②的离子积常数为Kw,Fe3+发生水解反应的平衡常数:K=___(用含Kw、Ksp的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有五种化合物是分别由以下原子![]() 团
团![]() 中的两种不同的原子
中的两种不同的原子![]() 团
团![]() 组成的:
组成的:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 。已知A是一种能发生银镜反应的酸,它跟B在一定条件下可生成C和
。已知A是一种能发生银镜反应的酸,它跟B在一定条件下可生成C和![]() ,C是D的同分异构体,E可在碱性条件下和
,C是D的同分异构体,E可在碱性条件下和![]() 反应生成B。按要求回答问题
反应生成B。按要求回答问题![]() 提示:所有物质所含碳原子均不超过两个,以上基团可以重复使用
提示:所有物质所含碳原子均不超过两个,以上基团可以重复使用![]()
(1)C的结构简式__________;
(2)A与D的关系______________________![]() 填序号
填序号![]() ;
;
①同系物 ②同分异构体 ③同种物质 ④同位素 ⑤同素异形体
(3)请写出相对分子质量与D相等且属于饱和一元醇的所有同分异构体的结构简式______;
(4)请写出下列反应的方程式:![]() 转化的离子方程式:_____________;C与氢氧化钠水溶液反应的化学方程式:_________。
转化的离子方程式:_____________;C与氢氧化钠水溶液反应的化学方程式:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知元素X、Y原子序数均不大于20。某含氧酸盐甲的化学式为XYO3。请回答:
(1)若常温下Y的单质能与水发生反应,X原子序数大于Y,则X位于周期表的_____,X、Y形成简单离子半径大小关系为X______(填“大于”“小于”或“等于”)Y。395℃时,甲能发生分解反应生成两种盐,一种是含Y元素的无氧酸盐,该反应的化学方程式是_____________。
(2)若甲灼烧时,火焰呈现砖红色,且与盐酸反应时产生有刺激性气味气体。则甲为__(填化学式)。该气体能使高锰酸钾溶液褪色,反应的离子方程式为_____。
(3)若X、Y是不同周期的短周期元素,甲与盐酸反应逸出无色无味气体乙。
则:①乙中所含化学键类型为_______。
②该反应的离子方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某密闭容器中充入一定量N2、H2发生反应N2(g)+3H2(g)![]() 2NH3(g),测得NH3浓度与反应温度关系如图。下列说法正确的是( )
2NH3(g),测得NH3浓度与反应温度关系如图。下列说法正确的是( )
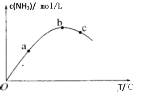
A.该反应△H>0
B.N2转化率:c>b>a
C.化学反应速率:c>b>a
D.平衡常数K:b>c>a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,0.1 mol·L-1某一元酸(HA)溶液中c(OH-)/c(H+)=1×10-8下列叙述正确的是
A. 该一元酸的电离方程式为HA = H++ A-
B. 该溶液中由水电离出的c(H+)=1×10-11mol·L-1
C. 该溶液中水的离子积常数为1×10-22
D. 将pH=11的NaOH溶液V1L与V2L 0.1 mol·L-1该一元酸(HA)溶液混合,若混合溶液的pH=7,则混合溶液中有关离子浓度为c(Na+)>c(OH-)>c(A-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是![]()
A.常温下,在![]() 溶液中加入少量
溶液中加入少量![]() 晶体,能使
晶体,能使![]() 的电离度降低,溶液的pH增大
的电离度降低,溶液的pH增大
B.常温下向氯化铵溶液中加入少量氨水使溶液中![]() ,则混合液的
,则混合液的![]()
C.pH均为5的盐酸和硫酸氢钠溶液中,水的电离程度后者大
D.![]() 的
的![]()
![]() 溶液与
溶液与![]()
![]() 溶液等体积混合后所得溶液中:
溶液等体积混合后所得溶液中:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com