
【题目】甲烷、乙烯、环氧乙烷、丁烷都是重要的化工原料,用途广泛,回答下列问题:
已知:Ⅰ.2CH2=CH2(g)+O2(g)2![]() (g) ΔH1<0
(g) ΔH1<0
Ⅱ.CH2=CH2(g)+3O2(g)2CO2(g)+2H2O(l) ΔH2
Ⅲ.2![]() (g) +5O2(g) 4CO2(g)+4H2O(l) ΔH3
(g) +5O2(g) 4CO2(g)+4H2O(l) ΔH3
(1)若反应Ⅲ是在一定温度下可自发进行,则ΔH3______(填“>”“<”或“=”)0。
(2)热值是表示单位质量的燃料完全燃烧时所放出的热量,是燃料质量的一种重要指标。已知乙烯的热值为50.4kJ·g-1,则△H2=________kJ·mol-1。
(3)实验测得2CH2=CH2(g)+O2(g)2![]() (g) ΔH1<0中,v正=k正·c2(CH2=CH2)·c(O2),v逆=k逆·c2(
(g) ΔH1<0中,v正=k正·c2(CH2=CH2)·c(O2),v逆=k逆·c2(![]() )(k正、k逆为速率常数,只与温度有关)。
)(k正、k逆为速率常数,只与温度有关)。
①达到平衡后,仅升高温度,k正增大的倍数________(填“大于”“小于”或“等于”) k逆增大的倍数。
②若在1L的密闭容器中充入1mol CH2=CH2(g)和1mol O2(g),在一定温度下只发生反应Ⅰ,经过10min 反应达到平衡,CH2=CH2(g)的转化率为40%,则0~10min内,v(O2)=_________,![]() =___________(保留两位有效数字)。
=___________(保留两位有效数字)。
(4)下列有关环氧乙烷制备的说法正确的是________(填字母)。
A.由图1可知,进料气体的初始温度对环氧乙烷的选择性影响不大,可得出乙烯的转化率受初始温度的影响不大
B.由图2可知,原料气的流速加快,乙烯转化率下降,主要是原料气与催化剂接触时间过短造成
C.若进料气中氧气比例增大,环氧乙烷产率降低,其主要原因是部分乙烯、环氧乙烷转化为二氧化碳和水
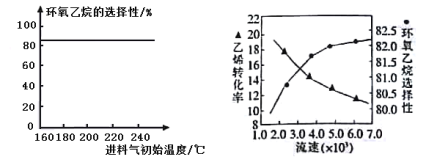
图1环氧乙烷选择性与进料气体初始温度关系 图2乙烯转化率-环氧乙烷选择性与进料气体流速关系
(5)一种以天然气为物燃料的固体氧化物燃料电池的原理如图所示,其中YSZ为6%~10%Y2O3掺杂的ZrO2固体电解质。
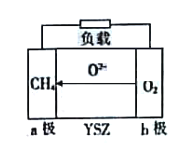
a极上的电极反应式为_____________;若电路中转移0.1mol电子,则消耗标准状况下CH4的体积为_____________ L。
【答案】< -1411.2 小于 0.02mol/(Lmin) 0.56 BC CH4-8e- +4O2- =CO2+2H2O 0.28
【解析】
(1)反应Ⅲ:2![]() (g) +5O2(g)4CO2(g)+4H2O(l)是体系混乱度减小的反应,根据ΔG=ΔH-TΔS<0分析判断;
(g) +5O2(g)4CO2(g)+4H2O(l)是体系混乱度减小的反应,根据ΔG=ΔH-TΔS<0分析判断;
(2)结合热值计算乙烯的燃烧热,根据盖斯定律,将![]() ×(Ⅰ+Ⅲ)整理可得;
×(Ⅰ+Ⅲ)整理可得;
(3)①反应2CH2=CH2(g)+O2(g)2![]() (g)ΔH1<0的正反应是放热反应,在其他条件不变时,升高温度,v正、v逆都增大,由于温度对吸热反应影响更大,结合v正=k正·c2(CH2=CH2)·c(O2),v逆=k逆·c2(
(g)ΔH1<0的正反应是放热反应,在其他条件不变时,升高温度,v正、v逆都增大,由于温度对吸热反应影响更大,结合v正=k正·c2(CH2=CH2)·c(O2),v逆=k逆·c2(![]() )分析判断;
)分析判断;
②达到平衡时乙烯的转化率为40%,则参与反应的乙烯的物质的量为1mol×40%=0.4mol,根据反应计算氧气的物质的量进而计算v(O2);反应达到平衡时,计算化学平衡常数K;由于反应达到平衡时,v正=v逆,所以k正·c2(CH2=CH2)·c(O2)= k逆·c2(![]() );
);
(4)A.根据图示可知,进料气体的初始温度对环氧乙烷的选择性影响不大,可能是温度对副反应的影响较小造成的,但不能得到初始温度对乙烯的转化率影响不大的结论;
B.流速越快,反应物接触时间越短,消耗乙烯的量越少;
C.若进料气中O2比例增大,环氧乙烷与氧发生副反应转化为氧化碳和水;
(5)根据图示可知在a电极通入甲烷为负极,失去电子发生氧化反应;根据电极反应计算CH4的物质的量,再利用V=nVm计算。
(1)反应Ⅲ:2![]() (g) +5O2(g)4CO2(g)+4H2O(l)是体系混乱度减小的反应,ΔS<0,若在一定温度下可自发进行,根据ΔG=ΔH-TΔS<0,ΔS<0则ΔH<0,即ΔH3<0;
(g) +5O2(g)4CO2(g)+4H2O(l)是体系混乱度减小的反应,ΔS<0,若在一定温度下可自发进行,根据ΔG=ΔH-TΔS<0,ΔS<0则ΔH<0,即ΔH3<0;
(2)热值是表示单位质量的燃料完全燃烧时所放出的热量,是燃料质量的一种重要指标。已知乙烯的热值为50.4kJ·g-1,则1mol乙烯的燃烧热为-50.4 kJ·g-1×28g/mol=-1411.2kJ·mol-1,根据盖斯定律,将![]() ×(Ⅰ+Ⅲ)整理可得,CH2=CH2(g)+3O2(g)2CO2(g)+2H2O(l) ΔH2=
×(Ⅰ+Ⅲ)整理可得,CH2=CH2(g)+3O2(g)2CO2(g)+2H2O(l) ΔH2=![]() ×(H1+ H3)= -1411.2kJ·mol-1;
×(H1+ H3)= -1411.2kJ·mol-1;
(3)①反应2CH2=CH2(g)+O2(g)2![]() (g)ΔH1<0的正反应是放热反应,在其他条件不变时,升高温度,v正、v逆都增大,由于温度对吸热反应影响更大,所以v逆增大的比v正最大的多,使得v正<v逆,所以化学平衡向逆向移动,v正=k正·c2(CH2=CH2)·c(O2),v逆=k逆·c2(
(g)ΔH1<0的正反应是放热反应,在其他条件不变时,升高温度,v正、v逆都增大,由于温度对吸热反应影响更大,所以v逆增大的比v正最大的多,使得v正<v逆,所以化学平衡向逆向移动,v正=k正·c2(CH2=CH2)·c(O2),v逆=k逆·c2(![]() ),因此达到平衡后,仅升高温度,k正增大的倍数小于k逆增大的倍数;
),因此达到平衡后,仅升高温度,k正增大的倍数小于k逆增大的倍数;
②根据方程式可知,乙烯与氧气反应的物质的量之比为span>2:1,由于开始时加入了1mol乙烯,达到平衡时乙烯的转化率为40%,则参与反应的乙烯的物质的量为1mol×40%=0.4mol,所以反应的氧气的物质的量为0.2mol,故0~10min内v(O2)=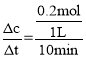 =0.02mol/(Lmin);反应达到平衡时c(CH2=CH2)=
=0.02mol/(Lmin);反应达到平衡时c(CH2=CH2)=![]() =0.6mol/L,c(O2)=
=0.6mol/L,c(O2)=![]() = 0.8mol/L,c(
= 0.8mol/L,c(![]() )=
)=![]() =0.4mol/L,化学平衡常数K=
=0.4mol/L,化学平衡常数K=![]() =
=![]() ;由于反应达到平衡时,v正=v逆,所以k正·c2(CH2=CH2)·c(O2)= k逆·c2(
;由于反应达到平衡时,v正=v逆,所以k正·c2(CH2=CH2)·c(O2)= k逆·c2(![]() ),故
),故![]() =
=![]() =K=
=K=![]() =0.56;
=0.56;
(4)A.根据图示可知,进料气体的初始温度对环氧乙烷的选择性影响不大,可能是温度对副反应的影响较小造成的,但不能得到初始温度对乙烯的转化率影响不大的结论,实际上升高温度,物质转化率相对有较大影响,故A错误;
B.流速越快,反应物与催化剂接触时间越短,消耗乙烯的量越少,导致乙烯转化率下降,故B正确;
C.若进料气中O2比例增大,环氧乙烷产率降低,其主要原因是环氧乙烷与氧发生副反应转化为氧化碳和水,故C正确;
故答案选BC;
(5)根据图示可知,该装置为燃料电池,通入燃料的一极为负极,在a电极通入甲烷为负极,失去电子发生氧化反应,电极反应式为CH4-8e- +4O2- =CO2+2H2O,每有1 molCH4发生反应,转移8 mol电子;若电路中转移0.1 mol电子,消耗CH4的物质的量为n(CH4)=![]() ×0.1 mol=0.0125 mol,其在标准状况下的体积V(CH4)=nVm=0.0125mol×22.4 L/mol=0.28 L。
×0.1 mol=0.0125 mol,其在标准状况下的体积V(CH4)=nVm=0.0125mol×22.4 L/mol=0.28 L。


科目:高中化学 来源: 题型:
【题目】工业合成氨的反应N2+3H2===2NH3的能量变化如图所示,请回答有关问题:
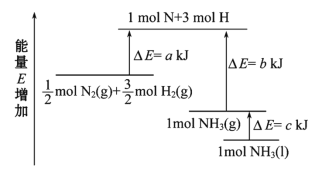
(1)合成1 mol NH3(l)________(填“吸收”或“放出”)________ kJ的热量。
(2)已知:拆开 1 mol H—H键、1 mol N—H键、1 mol N≡N 键分别需要的能量是436 kJ、391 kJ、946 kJ。则图中的a=________ kJ;1 mol N2(g) 完全反应生成NH3(g)产生的能量变化为________ kJ。
(3)推测反应 2NH3(l)=== 2N2 (g)+3H2(g) 比反应2NH3(g)=== 2N2 (g)+3H2(g) ______(填“吸收”或“放出”)的热量________(填“多”或“少”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究化学反应速率和化学反应限度的有关问题,某研究小组进行了以下实验:
实验一:为探究反应物浓度对化学反应速率的影响,设计的实验方案如下表。
(已知I2+2S2O![]() ==S4O
==S4O![]() +2I- ,其中Na2S2O3溶液均足量,且S2O
+2I- ,其中Na2S2O3溶液均足量,且S2O![]() 与S4O
与S4O![]() 均为无色)
均为无色)
实验序号 | 体积V/mL | 蓝色褪去时间/s | |||
Na2S2O3溶液 | 淀粉溶液 | 碘水 | 水 | ||
① | 10.0 | 2.0 | 4.0 | 0.0 | t1 |
② | 8.0 | 2.0 | 4.0 | 2.0 | t2 |
③ | 6.0 | 2.0 | 4.0 | Vx | t3 |
(1)表中Vx=_________mL,t1、t2、t3的大小关系是___________________
实验二:取5 mL 0.1 mol·L-1的KI溶液于试管中,滴加0.1 mol·L-1 FeCl3溶液2 mL,发生如下反应:2Fe3++2I-=2Fe2+ +I2,为证明该反应存在一定的限度,他们设计了如下实验:
①取少量反应液,滴加AgNO3溶液,发现有少量黄色沉淀(AgI)。
②再取少量反应液,滴加少量CCl4 ,振荡,发现CCl4层显浅紫色。
根据①②的现象,/span>他们得出结论:该反应具有一定的可逆性,在一定条件下会达到反应限度。
(2)指导老师指出上述实验①不合理,其原因是_______________ ; 你的改进方案是________(简要写出操作、试剂和现象)。
(3)实验②适合检验生成I2较多的情况,还有一种简便的方法可以灵敏地检验是否生成了I2,这种方法所用的试剂是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物邻二乙烯苯广泛用于制造离子交换树脂,其结构简式如图所示,下列关于邻二乙烯苯的说法不正确的是
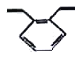
A.1 mol邻二乙烯苯含有5 mol碳碳双键
B.所有的原子可能在同一平面
C.能发生加成反应,也能发生取代反应
D.苯环上的二氯代物有4种(不考虑立体结构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科研人员研制出透氧膜,它允许e-和O2-同时通过,可实现水连续分解制备氢气,工作时CO、H2O分别在透氧膜的两侧反应。工作原理如图所示,下列说法正确的是
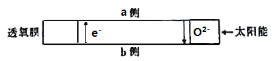
A.CO在a侧上反应
B.b侧的反应式:H2O+2e- = H2↑+ O2-
C.该透氧膜可实现太阳能向氢能的转化
D.当有2mol电子通过透氧膜时,就会消耗22.4L CO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮是地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义。
(1)下图是1 mol NO2和1 mol CO反应生成CO2和NO过程中能量变化示意图,写出NO2和CO反应的热化学方程式___________________。

(2)已知:N2(g)+O2(g)=2 NO(g) △H=+178 kJ·mol-1
2NO(g)+2 CO(g)=N2(g)+2 CO2(g)△H=-743kJ·mol-1
则反应CO(g)+1/2O2(g)=CO2(g)的△H=_______kJ·mol-1
(3)在一固定容积为2L的密闭容器内加入1.5 mol的N2和5 mol的H2,在一定条件下发生如下反应:N2+3H2![]() 2NH3,若第5分钟时达到平衡,此时测得NH3的物质的量为2mol,则前5分钟的平均反应速率υ(N2)为_________,平衡时H2的转化率为_________,该反应的平衡常数K=__________。
2NH3,若第5分钟时达到平衡,此时测得NH3的物质的量为2mol,则前5分钟的平均反应速率υ(N2)为_________,平衡时H2的转化率为_________,该反应的平衡常数K=__________。
(4)在体积一定的密闭容器中能说明合成氨反应一定达到平衡状态的是_____;在压强一定的密闭容器中能说明合成氨反应一定达到平衡状态的是_____
a. 容器内N2、H2、NH3的浓度之比为1:3:2 b. NH3的浓度保持不变
c. 容器内压强保持不变 d. 混合气体的密度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究KI与FeCl3的反应为可逆反应,且有一定的限度,某化学小组进行了两组实验:
(1)请写出KI溶液与FeCl3溶液反应的离子反应方程式:______;
实验I:探究KI与FeCl3的反应为可逆反应
步骤1:设计如下图原电池装置,接通灵敏电流计,指针向左偏转(注:灵敏电流计指针总是偏向电源正极),随着时间进行电流计读数逐渐变小,最后读数变为零。
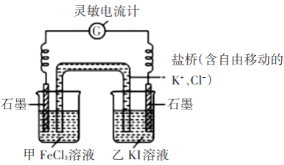
步骤2:当指针读数变零后,向甲中加入少量FeCl2固体,向乙中加入少量碘固体;
(2)若灵敏电流计出现_________(答现象),则证明该反应为可逆反应。实验结论:该反应为可逆反应。
(3)根据以上实验结论解释步骤1中“最后读数变为零”的原因_______;
(4)加入FeCl2和碘固体后,正极的电极反应式为______;
实验II:证明KI与FeCl3的反应有一定限度。
步骤3:取5 mL 0.1 mol/L的KI溶液于试管,滴加0.1 mol/L的FeCl3溶液2 mL,振荡;
步骤4:取少量反应后的溶液,向其中加入几滴淀粉溶液,充分振荡;
(5)观察到的现象是________;
步骤5:另取少量反应后的溶液,滴加0.1 mol/L的AgNO3溶液,振荡,产生黄色沉淀,则证明该反应有一定限度。
(6)但有同学认为步骤5现象不能证明得出的结论,原因是______,修正实验方案后得到结论:该反应有一定的限度。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一氧化二氮俗称笑气,是一种氧化剂,也可以用来作为火箭和赛车的氧化剂。值得注意的是,N2O是一种强大的温室气体,它的效果是二氧化碳的296倍,因此研究其分解对环境保护有着重要意义。
(1)一氧化二氮早期被用于牙科手术的麻醉,它可由硝酸铵在催化剂下分解制得,该反应的化学方程式为______________。
(2)已知反应2N2O(g)![]() 2N2(g)+O2(g)的ΔH=-163kJ/mol, 1mol N2(g)、1mol O2(g) 分子中化学键断裂时分别需要吸收945kJ、498kJ 的能量,则1mol N2O(g)分子中化学键断裂时需要吸收的能量为_________________________________________ kJ。
2N2(g)+O2(g)的ΔH=-163kJ/mol, 1mol N2(g)、1mol O2(g) 分子中化学键断裂时分别需要吸收945kJ、498kJ 的能量,则1mol N2O(g)分子中化学键断裂时需要吸收的能量为_________________________________________ kJ。
(3)碘蒸气存在能大幅度提高2N2O(g)![]() 2N2(g)+O2(g)的分解速率,反应历程为:
2N2(g)+O2(g)的分解速率,反应历程为:
第一步I2(g)![]() 2I(g)(快反应)
2I(g)(快反应)
第二步________________________(慢反应)
第三步IO(g)+N2O(g)![]() N2(g)+O2(g)+I(g)(快反应)
N2(g)+O2(g)+I(g)(快反应)
第二步反应方程式为__________________________________,活化能最大的是第____步反应。
(4)T℃下将N2O充入5L的刚性容器中,发生反应2N2O(g)![]() 2N2(g)+O2(g)的部分实验数据如图:
2N2(g)+O2(g)的部分实验数据如图:
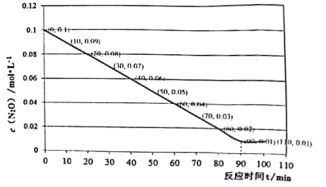
①T℃该反应的平衡常数值为________________,100min 时,向容器中加入0.1mol N2O和0.9mol N2,此时平衡________________(填“向正反应方向移动、向逆反应方向移动、不移动”)。
②半衰期是指任一浓度N2O消耗一半时所需的相应时间。N2O从某一浓度到另一浓度需要时间t可表示为![]() 其中kp为速率常数,p、p0均为N2O的分压。1030K下,在一刚性容器中充入N2O气体发生分解反应,当初始压力为a kPa,半衰期时容器总压强为___________,当容器内总压强到达b kPa时,反应所需的时间为___________。 (用代数式表示,不用化简) [已知:1030K时,kp=9.8×105(kPa·s-1)]
其中kp为速率常数,p、p0均为N2O的分压。1030K下,在一刚性容器中充入N2O气体发生分解反应,当初始压力为a kPa,半衰期时容器总压强为___________,当容器内总压强到达b kPa时,反应所需的时间为___________。 (用代数式表示,不用化简) [已知:1030K时,kp=9.8×105(kPa·s-1)]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大环多醚称为冠醚。二苯并-18-冠-6的结构简式如图所示。下列说法不正确的是
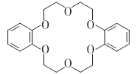
A.该有机物的分子式为C20H24O6
B.该有机物中所有原子不可能共平面
C.在光照下,该有机物与氯气反应的一氯代物有4种(不考虑立体异构)
D.1 mol该有机物的苯环最多可与6 mol H2发生加成反应(不考虑开环加成)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com