
| A. | 甲苯中所有原子都处于同一平面内 | |
| B. | 甲烷和乙烯都可以与氯气反应 | |
| C. | 酸性高锰酸钾溶液可以氧化苯和甲烷 | |
| D. | 乙烯可以与氢气发生加成反应,苯不能与氢气加成 |
分析 A.甲基具有甲烷的结构特点;
B.甲烷可发生取代反应,乙烯可发生加成反应;
C.苯、甲烷与高锰酸钾都不反应;
D.苯与氢气发生加成反应生成环己烷.
解答 解:A.甲基为饱和烃基,具有甲烷的结构特点,所有原子不处于同一平面内,故A错误;
B.甲烷在光照条件下与氯气发生取代反应,乙烯含有碳碳双键,可与氯气发生加成反应,故B正确;
C.苯性质稳定、甲烷为饱和烷烃,与高锰酸钾都不反应,故C错误;
D.苯与氢气发生加成反应生成环己烷,故D错误.
故选B.
点评 本题综合考查有机物的结构和性质,为高频考点,侧重于学生的分析能力的考查,注意把握有机物的组成、结构和性质,注意相关基础知识的积累,难度不大.


科目:高中化学 来源: 题型:解答题
| 时间 | 开始 | 8h后 | 16h后 | 24h后 | 32h后 | 40h后 |
| pH | 5.0 | 4.8 | 4.5 | 4.3 | 4.2 | 4.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 和间苯二胺
和间苯二胺 在一定条件下以等物质的量缩聚而成.写出Nomex纤维的结构简式:
在一定条件下以等物质的量缩聚而成.写出Nomex纤维的结构简式: .
.
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 氧化剂 | I2的物质的量(mol) | 氧化剂 | I2的物质的量(mol) |
| H2O2 | IO3- | ||
| MnO4- | HNO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)C、N、O三种元素第一电离能从大到小的顺序是N>O>C.
(1)C、N、O三种元素第一电离能从大到小的顺序是N>O>C.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
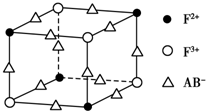 已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大,其中A、B、C、D、E为不同主族的元素.A、C的最外层电子数都是其电子层数的2倍,B的电负性大于C,透过蓝色钴玻璃观察E的焰色反应为紫色,F的基态原子中有4个未成对电子.
已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大,其中A、B、C、D、E为不同主族的元素.A、C的最外层电子数都是其电子层数的2倍,B的电负性大于C,透过蓝色钴玻璃观察E的焰色反应为紫色,F的基态原子中有4个未成对电子. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量/mg | 200 | 300 | 400 |
| 气体体积/Ml | 224 | 280 | 280 |
| 剩余固体/mg | 14 | 67.5 | 167.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com