
【题目】端炔烃在催化剂存在下可发生偶联反应,成为Glaser反应。
2R-C≡C-H ![]() R-C≡C-C≡C-R+H2
R-C≡C-C≡C-R+H2
该反应在研究新型发光材料、超分子化学等方面具有重要价值。下面是利用Glaser反应制备化合物E的一种合成路线:

回答下列问题:
(1)D 的化学名称为____________________。
(2)③的反应类型分别为________________________。
(3)E的结构简式为____________________________。
(4)化合物 ( HC≡C—![]() —C≡CH )也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为_________________________________________。
—C≡CH )也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为_________________________________________。
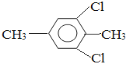
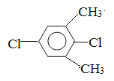
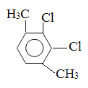
(5)芳香化合物F是C的同分异构体,其分子中只有两种不同化学环境的氢,数目比为3∶1,写出其中3种的结构简式___________________________________________________。
(6)F的所有同分异构体在下列一种表征仪器中显示的信号(或数据)完全相同,该仪器是________________(填标号)
A.质谱仪 B.红外光谱仪 C.元素分析仪 D.核磁共振仪
【答案】苯乙炔 消去反应 ![]() —C≡C—C≡C—
—C≡C—C≡C—![]() n HC≡C—
n HC≡C—![]() —C≡C
—C≡C ![]() H
H![]() C≡C—
C≡C—![]() —C≡C
—C≡C![]() H+(n-1)H2
H+(n-1)H2 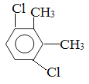 、
、 、
、 、
、 、
、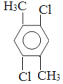 或其它合理答案 C
或其它合理答案 C
【解析】
由B的分子式、C的结构简式可知B为![]() ,则A与一氯乙烷发生取代反应生成B,故A为
,则A与一氯乙烷发生取代反应生成B,故A为![]() ,对比C、D的结构可知C脱去2分子HCl,同时形成碳碳三键得到D,该反应属于消去反应。D发生信息中的偶联反应生成E为
,对比C、D的结构可知C脱去2分子HCl,同时形成碳碳三键得到D,该反应属于消去反应。D发生信息中的偶联反应生成E为![]() 。
。
(1)D的结构简式为![]() ,其化学名称为:苯乙炔;
,其化学名称为:苯乙炔;
(2)反应③是C分子内脱去2分子HCl,同时形成碳碳三键生成D,反应类型为消去反应;
(3)D发生信息中的偶联反应生成E为![]() ;
;
(4)化合物(![]() )也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为:
)也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为: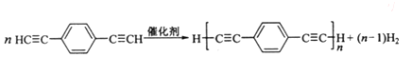 ;
;
(5)芳香化合物F是C的同分异构体,其分子中只有两种不同化学环境的氢,数目比为3:1,可能的结构简式为: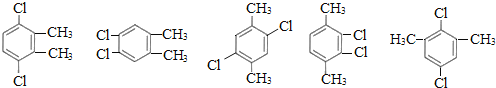 (任意3种);
(任意3种);
(6)F的所有同分异构体含有的元素种类相同,在元素分析仪中显示信号完全相同。含的高能碎片不完全相同,在质谱仪中信号显示不完全相同;由于含有的基团不完全相同,在红外光谱仪中显示的信号不完全相同;含有的氢元素种类不完全相同,在核磁共振仪中显示信号不完全相同,故答案为C。


科目:高中化学 来源: 题型:
【题目】卤块的主要成分是MgCl2,此外还含Fe3+、Fe2+和Mn2+等离子。若以它为原料按下图所示工艺流程进行生产,可制得轻质氧化镁。
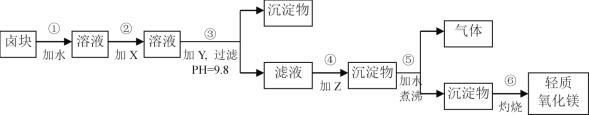
表1
物质 | 开始沉淀 | 沉淀完全 |
Fe(OH)3 | 2.7 | 3.7 |
Fe(OH)2 | 7.6 | 9.6 |
Mn(OH)2 | 8.3 | 9.8 |
Mg(OH)2 | 9.6 | 11.1 |
﹡Fe2+氢氧化物呈絮状,不易从溶液中除去,必须将它氧化后以Fe(OH)3沉淀形式才能除尽
表2
物质 | 价格(元/吨) |
漂白液(含25.2%NaClO) | 450 |
双氧水(含30%H2O2) | 2400 |
烧碱(含98%NaOH) | 2100 |
纯碱(含99.5%Na2CO3) | 600 |
若要求产品尽量不含杂质,而且生产成本较低,根据表1和表2提供的资料,回答下列问题:
(1)步骤②中加入的试剂X,最佳选择_____________(填物质名称),其作用是___________________。
(2)步骤③生成的沉淀物含有____________________(填化学式)。
(3)步骤⑤中发生反应的化学方程式为_____________________________。
(4)若在实验室进行步骤⑥的灼烧实验,必须用到的仪器是铁三脚、酒精喷灯、________和泥三角。
(5)在实验室中,为了除去MgCl2酸性溶液中的Fe3+而得到较纯净的MgCl2溶液,可在加热搅拌的条件下加入一种试剂,过滤后,再向滤液中加入适量的盐酸,这种试剂是____________(填字母)。
A.NH3·H2O B.NaOH C.Na2CO3 D.MgCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、N、X、Y、Z是原子序数依次增大的短周期主族元素。Y所处的周期序数与族序数相等。甲、乙、丙、丁、戊是由这些元素组成的化合物,丁是氯碱工业的-种产物,戊为二元化合物,常温下0.01 mol·L— 1戊溶液的pH为2。上述物质的转化关系如图所示。下列说法中错误的是

A.原子半径: N<Y<XB.W2N分子的比例模型为![]()
C.物质丁中含有离子键和共价键D.丙在固态时属于分子晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由CH3CH2CH2Br制备CH3CH(OH)CH2OH,依次发生的反应类型和反应条件都正确的是
选项 | 反应类型 | 反应条件 |
A | 加成、取代、消去 | KOH醇溶液/加热、KOH水溶液/加热、常温 |
B | 消去、加成、取代 | NaOH醇溶液/加热、常温、KOH水溶液/加热 |
C | 氧化、取代、消去 | 加热、KOH醇溶液/加热、KOH水溶液/加热 |
D | 消去、加成、水解 | NaOH水溶液/加热、常温、NaOH醇溶液/加热 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y两种有机物的分子式不同,但均含有C、H或C、H、O,将X、Y以任意比例混合,只要物质的量之和不变,完全燃烧时所消耗的氧气量和生成水的物质的量也分别不变。则下列有关判断正确的是 ( )
A. X、Y分子式中氢原子数一定要相同,碳原子数必定相同
B. 若X为CH4,则相对分子质量最小的Y是甲醇
C. 若X为CH4,则相对分子质量最小的Y是乙二醇
D. X、Y的化学式应含有相同的氢原子数,且相差n个碳原子,同时相差2n个氧原子(n为正整数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜板上铁铆钉长期暴露在潮湿的空气中,形成一层酸性水膜后铁铆钉会被腐蚀,示意图如下。下列说法不正确的是

A. 腐蚀过程中铜极上始终只发生: 2H++2e-= H2↑
B. 若水膜中溶有食盐将加快铁铆钉的腐蚀
C. 若在金属表面涂一层油脂能防止铁铆钉被腐蚀
D. 若将该铜板与直流负极相连,则铁铜均难被腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应COCl2(g)![]() CO(g)+Cl2(g) ΔH>0,达到平衡时,下列措施:
CO(g)+Cl2(g) ΔH>0,达到平衡时,下列措施:
①升温 ②恒容通入惰性气体 ③增加CO浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是( )
A.①②④B.①④⑥C.②③⑤D.③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知298K时下列物质的溶度积
CH3COOAg | AgCl | AgCrO4 | AgS | |
Ksp | 2.3×10-3 | 1.77×10-10 | 1.12×10-12 | 6.7×10-15 |
下列说法正确的是( )
A.等体积浓度均为0.02molL-1的CH3COONa和AgNO3溶液混合能产生沉淀
B.浓度均为0.01molL-1的CrO42-和Cl-混合溶液中慢慢滴入AgNO3溶液时,CrO42-先沉淀
C.在CH3COOAg悬浊液中加入盐酸发生反应的离子方程式:CH3COOAg+H++C1-=CH3COOH+AgCl
D.298K时,上述四种饱和溶液的物质的量浓度:c(CH3COOAg)>c(AgCl)>c(Ag2CrO4)>c(Ag2S)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是用0.1000mol/L的盐酸滴定某未知浓度的NaOH溶液的示意图和某次滴定前、后的盛放盐酸滴定管中液面的位置.请回答:
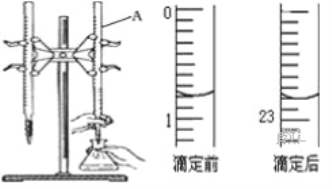
(1)仪器A的名称是__________________;
(2)盐酸滴定管中滴定后读数为_____________mL;
(3)某实验小组同学的三次实验的实验数据如下表所示.根据表中数据计算出的待测NaOH溶液的浓度是________________;(保留四位有效数字)
实验 编号 | 待测NaOH溶液的体积(mL) | 滴定前盐酸的 体积读数(mL) | 滴定后盐酸的 体积读数(mL) |
1 | 20.00 | 1.20 | 23.22 |
2 | 20.00 | 2.21 | 24.21 |
3 | 20.00 | 1.50 | 23.48 |
(4)滴定操作可分解为如下几步(所用的仪器刚用蒸馏水洗净):
A.用碱式滴定管向锥形瓶里注入20.00mL待测NaOH溶液,并加入2~3滴酚酞;
B.用标准溶液润洗酸式滴定管2~3次;
C.把盛有标准溶液的酸式滴定管固定好,调节滴定管尖嘴使之充满溶液,使管内无气泡;
D.取标准盐酸注入酸式滴定管至刻度0以上2~3cm;
E.调节液面至0或0以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,用标准盐酸滴定至终点并记下滴定管液面的刻度。
正确操作步骤的顺序是(用序号字母填写)_____________;
(5)判断到达滴定终点的实验现象是________________________________;
(6)滴定操作时,如果上述B步骤省略,对测定结果的影响是_____(填“无影响”、“偏高”或“偏低”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com