(2013?泰安一模)研究碳及其化合物的性质对促进低碳社会的构建具有重要意义.
(1)将不同量的CO(g)和H
2O(g)分别通入体积为2L的恒容密闭容器中,进行反应 CO(g)+H
2O(g)?CO
2(g)+H
2(g),得到如下两组数据:
| 实验组 |
温度℃ |
起始量/mol |
平衡量/mol |
达到平衡所需时间/min |
| CO |
H2O |
H2 |
CO |
| 1 |
650 |
4 |
2 |
1.6 |
2.4 |
6 |
| 2 |
900 |
2 |
1 |
0.4 |
1.6 |
3 |
①实验1中以CO
2表示的反应速率为
0.13mol/(L?min)
0.13mol/(L?min)
(保留2位小数);
②该反应为
放热
放热
(填“吸热”或“放热”)反应;
③实验2的平衡常数为
0.17
0.17
.
(2)已知在常温常压下:
2CH
3OH(l)+3O
2(g)=2CO
2(g)+4H
2O(l)△H=-1451.6kJ?mol
-12CO(g)+O
2(g)=2CO
2(g)△H=-566.0kJ?mol
-1写出甲醇不完全燃烧生成CO和液态水的热化学方程式
CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ/mol
CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ/mol
.
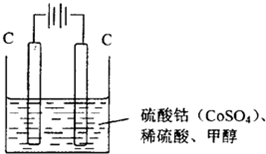
(3)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,实验室用如图装置模拟该过程,其原理是:通电后,Co
2+被氧化成Co
3+,然后以Co
3+做氧化剂把甲醇氧化成CO
2而除去(Co
3+的还原产物是CO
2+).
①写出阳极电极反应式
Co2+-e-=Co3+
Co2+-e-=Co3+
;
②写出除去甲醇的离子方程式
6Co3++CH3OH+H2O=CO2↑+6Co2++6H+
6Co3++CH3OH+H2O=CO2↑+6Co2++6H+
.

 (2013?泰安一模)研究碳及其化合物的性质对促进低碳社会的构建具有重要意义.
(2013?泰安一模)研究碳及其化合物的性质对促进低碳社会的构建具有重要意义.

 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案 (2013?泰安一模)用选项中的电极、溶液和如图所示装置可组成原电池.下列现象或结论叙述正确的是( )
(2013?泰安一模)用选项中的电极、溶液和如图所示装置可组成原电池.下列现象或结论叙述正确的是( )