
【题目】1,2一二氯乙烯有如图两种结构
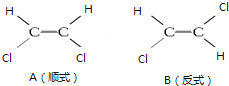
试回答下列问题:
(1)A、B分子中所含化学键类型__________(填“相同”或“不同”,下同),分子极性___________;
(2)A、B两种分子在CCl4中溶解度较大的是_________________;
(3)将A、B加入Br2的CCl4溶液中,可得物质C,则C的结构简式为__________,C物质_________(填“有”或“无”)手性异构体。
【答案】 相同 不同 B CHClBrCHClBr 有
【解析】试题分析:(1)A、B分子中所含化学键为碳氢共价键、碳氯共价键和碳碳双键;正负电荷重心重合的分子是非极性分子,正负电荷重心不重合的是极性分子;
(2)根据相似相溶原理;
(3)碳碳双键能与单质溴发生加成反应;先根据手性碳原子指连有四个不同基团的碳原子,手性碳原子判断注意:①手性碳原子一定是饱和碳原子;②手性碳原子所连接的四个基团要是不同的,然后根据手性分子存在手性异构体
解:(1)A、B分子中所含化学键为碳氢共价键、碳氯共价键和碳碳双键,化学键类型相同;B分子中正负电荷重心重合,是非极性分子,A分子中正负电荷重心不重合,是极性分子;
故答案为:相同;不同;
(2)极性分子易溶于极性分子组成的溶剂,非极性分子组成的溶质易溶于非极性分子组成的溶剂,CCl4是非极性分子,所以B分子在CCl4中溶解度较大;
故答案为:B;
(3)CHCl=CHCl能与单质溴发生加成反应,方程式为:CHCl=CHCl+Br2→CHClBrCHClBr;CHClBrCHClBr中的碳原子所连接的四个基团不一样,属于手性分子,存在手性异构体;
故答案为:CHClBrCHClBr;有.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ.从海水得到的粗食盐水中常含Ca2+、Mg2+、SO,需要分离提纯。现有含少量CaCl2、MgSO4的粗食盐水,在除去悬浮物和泥沙之后,要用4种试剂①盐酸;②Na2CO3;③NaOH;④BaCl2来逐一除去食盐水中Ca2+、Mg2+、SO。提纯的操作步骤和加入试剂的情况如图:
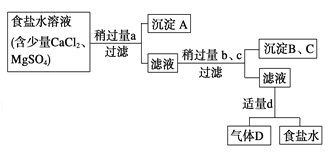
图中a、b、c、d分别表示上述4种试剂中的一种,试回答:
(1)沉淀A的名称是 ;
(2)试剂d是 ;判断试剂d已经足量的方法是__________________________;
(3)现有下列仪器,过滤出沉淀A、B、C时必须用到 (填序号),仪器③的名称是 。
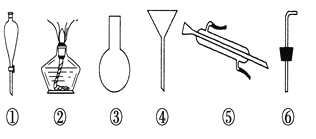
Ⅱ.海水蒸馏是由海水获得淡水的常用方法之一,在实验室里组成一套蒸馏装置肯定需要上述仪器中的一部分,则正确的是 (填序号)。
Ⅲ.海带等藻类物质经过处理后,可以得到碘水,欲从碘水中提取碘,需要上述仪器中的________ (填序号),该仪器名称为 ,向该碘水中加入四氯化碳以提取碘单质的实验操作为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分析下表中各项的排布规律,有机物X是按此规律排布的第19项,有关X的组成、性质的说法中肯定错误的是( )
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
CH4 | CH2O | CH2O2 | CH4O | C2H6 | C2H4O | C2H4O2 | C2H6O |
①是戊酸;②是戊醇;③是丁酸甲酯;④在稀硫酸中易变质;⑤一定能与钠反应
A.②⑤ B.①③④
C.③④ D.②③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:![]() 在固定容积的密闭容器中反应,达到平衡状态的标志是( )
在固定容积的密闭容器中反应,达到平衡状态的标志是( )
(1)单位时间内生成![]() 的同时生成
的同时生成![]()
(2)单位时间内生成![]() 的同时生成
的同时生成![]()
(3)用![]() 的物质的量浓度变化表示的反应速率的比为2:2:1的状态
的物质的量浓度变化表示的反应速率的比为2:2:1的状态
(4)混合气体的颜色不再改变的状态
A.(1)(4) B.(2)(3) C.(1)(3)(4) D.(1)(2)(3)(4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(10分) “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:

(1)写出制取乙酸乙酯的化学反应方程式 .
(2)浓硫酸的作用是:① ② .
(3)饱和碳酸钠溶液的主要作用是 .
(4)装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是防止 .
(5)若要把制得的乙酸乙酯分离出来,应采用的实验操作是 .
(6)做此实验时,有时还向盛乙酸和乙醇的试管里加入几块碎瓷片,其目的是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,常温下是一种橙黄色有恶臭的液体,它的分子结构如图所示.

(1)S2Cl2的结构式为 ,其化学键类型有 (填“极性键”“非极性键”或“极性键和非极性键”).
(2)电负性:S (填“>”或“<”)Cl,S2Cl2中硫的化合价为 .
(3)S2Cl2分子中S原子的杂化轨道类型为 ,每个S原子有 对弧电子对.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某学生为了探究锌与盐酸反应过程中的速率变化,他在100mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气(标准状况下),实验记录如下(累计值):
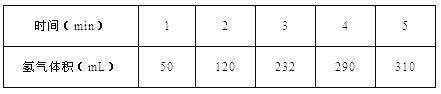
① 哪一时间段(指0~1、1~2、2~3、3~4、4~5min)反应速率最大_______。
②2~3分钟时间段以盐酸的浓度变化来表示的该反应速率______。(设溶液体积不变)
③如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体积的下列溶液:
A.蒸馏水、B.NaCl溶液、C.NaNO3溶液 D.CuSO4溶液 E.Na2CO3溶液,你认为可行的是___________。
(2)将等物质的量A、B混合于2L密闭容器中,发生如下反应3A(g)+B(g) ![]() xC(g)+2D(g),经5分钟后,测得D的浓度为0.5mol/L,此时A的浓度与B的浓度之比为3:5,C的平均反应速率是0.1mol/(L·min) 则平衡时A的浓度为__________mol/L,B的平均反应速率 ______mol/(L·min)。
xC(g)+2D(g),经5分钟后,测得D的浓度为0.5mol/L,此时A的浓度与B的浓度之比为3:5,C的平均反应速率是0.1mol/(L·min) 则平衡时A的浓度为__________mol/L,B的平均反应速率 ______mol/(L·min)。
(3)已知断裂1molC-H,O=O,C=O,H-O化学键所需能量分别为akJ,bkJ,ckJ,dkJ,则该反应CH4+O2=CO2+2H2O的反应热为△H=________kJ/mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在如图点滴板上有四个溶液间反应的小实验,其对应反应的离子方程式书写正确的是( )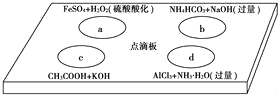
A.a反应:Fe2++2H++H2O2═Fe3++2H2O
B.b反应:HCO3﹣+OH﹣═CO32﹣+H2O
C.c反应:H++OH﹣═H2O
D.d反应:Al3++3NH3H2O═Al(OH)3↓+3NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. 化学反应除了生成新物质外,还伴随着能量的变化
B. 放热反应都不需要加热就能发生
C. 吸热反应在一定条件(如高温、加热等)下也能发生
D. 化学反应是放热还是吸热,取决于生成物具有的总能量和反应物具有的总能量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com