
| △c |
| △t |
| ||
| △c |
| △t |
| 1.2mol/L |
| 2min |
| ||
| 2min |
| ||
| 1.6 |
| 2 |


 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:
 某温度下,在2L密闭容器中X、Y、Z三种物质(均为气态)间进行反应,其物质的量随时间的变化曲线如图.依图回答:
某温度下,在2L密闭容器中X、Y、Z三种物质(均为气态)间进行反应,其物质的量随时间的变化曲线如图.依图回答:查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/°C | K1 | K2 |
| 500 | 1.00 | 3.5 |
| 700 | 1.47 | 2.26 |
| 900 | 2.40 | 1.60 |
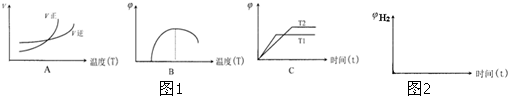
查看答案和解析>>
科目:高中化学 来源: 题型:
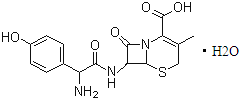
| A、头孢羟氨苄的化学式为C16H16N3O5S?H2O |
| B、1mol头孢羟氨苄与NaOH溶液和浓溴水反应时,分别需要消耗NaOH 4mol和Br2 3mol |
| C、在催化剂存在的条件下,1mol头孢羟氨苄消耗7molH2 |
| D、头孢羟氨苄在空气中能稳定存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间/s | 0 | 500 | 100 0 | 150 0 |
| c(N2O5)/mol?L-1 | 5.00 | 3.52 | 2.50 | 2.50 |
| A、500 s 内N2O5分解速率为2.96╳10-3mol?L-1?s-1 |
| B、达平衡时,N2O5的转化率为50% |
| C、达平衡后,升高温度平衡常数减小 |
| D、达平衡后,其他条件不变,将容器的体积压缩到原来的一半,c(N2O5)>5.00 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、化合反应一定是放热反应 |
| B、乙二醇和丙三醇都易溶于水和乙醇 |
| C、牺牲阳极的阴极保护法是利用了电解原理 |
| D、相同条件下,CuSO4溶液比FeCl3溶液使H2O2分解速率更快 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、③④ | C、①③ | D、②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com