
【题目】短周期主族元素X、Y、Z、R、T的原子半径与原子序数关系如图所示。其中X是原子半径最小的元素,R原子最外层电子数是电子层数的2倍,Y与Z能形成Z2Y、Z2Y2型离子化合物, T与Y 是同一主族元素。

(1)RX4的空间构型_____________,R在元素周期表中的位置_______________。
(2)比较X2Y、X2T稳定性强弱_________________(填化学式)
(3)判断RY2是________化合物(填“离子”或“共价”)写出RY2电子式____________,
(4)写出一个能判断R、T非金属性强弱的化学方程式________________________________。
(5)写出氯碱工业上制取Z、Y、X的离子方程式_________________________________________。
【答案】 正四面体 第二周期第ⅣA族 H2O>H2S 共价 ![]() Na2CO3+H2SO4=Na2SO4+CO2↑+H2O 2Cl-+2H2O
Na2CO3+H2SO4=Na2SO4+CO2↑+H2O 2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
【解析】考查元素周期表和元素周期律的应用,X是原子半径最小的元素,即X为H,R原子最外层电子数是电子层数的2倍,可以是C也可以是S,但根据原子序数的大小关系,即R为C,Y与Z可以形成Z2Y和Z2Y2的离子化合物,即Z为Na,Y为O,T与Y是同一主族元素,则T为S,(1)RX4是CH4,空间构型为正四面体,C位于第二周期IVA族;(2)X2Y为H2O,X2T为H2S,非金属性越强,其氢化物越稳定,同主族从上到下非金属性减弱,即稳定性:H2O>H2S;(3)RY2是CO2,属于共价化合物,其电子式为:![]() ;(4)利用它们最高价氧化物的水化物的酸性进行比较,酸性越强,其非金属性越强,即有Na2CO3+H2SO4=Na2SO4+CO2↑+H2O;(5)电解饱和食盐水,其离子反应方程式为:2Cl-+2H2O
;(4)利用它们最高价氧化物的水化物的酸性进行比较,酸性越强,其非金属性越强,即有Na2CO3+H2SO4=Na2SO4+CO2↑+H2O;(5)电解饱和食盐水,其离子反应方程式为:2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑。
2OH-+H2↑+Cl2↑。


科目:高中化学 来源: 题型:
【题目】下列说法:①硅的化学性质很稳定,因此硅在自然界中以游离态形式存在;②二氧化硅和二氧化碳在物理性质上有很大差异;③二氧化硅是一种酸性氧化物,它不可于任何酸发生反应.其中正确的是
A.①②③ B.①② C.①③ D.②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 苯中的少量苯酚可先加适量的浓溴水,再过滤而除去
B. 将苯酚晶体放入少量水中,加热时全部溶解,冷却到50℃形成悬浊液
C. 苯酚的酸性很弱,不能使酸碱指示剂变色,但可以和NaHCO3反应放出CO2
D. 苯酚有毒,不慎沾在皮肤上,可用酒精洗涤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用甲烷与氯气发生取代反应,同时获得副产品盐酸的设想在工业上已成为现实。某化学兴趣小组拟在实验室中模拟上述过程,其设计的模拟装置如下:

根据要求填空:
(1)导管a的作用是______________________。B装置有三种功能;①干燥混合气体;②将气体混合均匀;③___________________________。
(2)C装置中CH4与Cl2反应生成一氯代物的化学反应方式是_______________________。
D装置中的石棉上均匀附着潮湿的KI,写出反应的离子方程式是____________________。
(3)E装置中除了有盐酸生成外,还含有有机物。从E中分离出盐酸的最佳方法为___________
(4)E装置的作用是____________。(填序号)。
A.收集气体 B.吸收氯气 C.防止倒吸 D.吸收氯化氢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将下列各种液体:①苯;② 四氯化碳;③碘化钾溶液;④乙烯;⑤植物油,分别与溴水混合后充分振荡、静置,液体分为两层,原溴水层几乎是无色的是
A.②⑤ B.只有②④
C.①②④⑤ D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾天气严重影响人们的生活健康,治理污染是化学工作者义不容辞的职责,因而对SO2、NOx等进行研究其有重要意义。
请根据以下信息回答有关问题:
I.NOx是汽车尾气的主要污染物之一。
(1)汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:
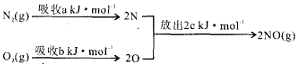
该反应的△H=__________。
(2)科学家通过实验发现,在紫外线照射下TiO2会使空气中的某些分子产生活性基团OH,并且活性基团OH可与NO2、NO发生反应生成硝酸和水。根据左下图示,请写出OH与NO反应的化学方程式__________。
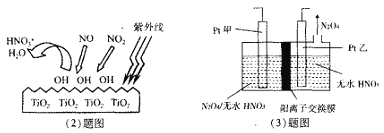
(3)电解法可将工业废气中含有的NO2消除。原理是先将NO2转化为N2O4,然后电解得到N2O5 (常温下为无色固体,常做绿色硝化剂)。电解原理如右上图所示,该电解池中生成N2O5的电极反应式是___________。
Ⅱ.工业上采取多种措施减少SO2的排放。
(4)碘循环工艺具体流程如下:
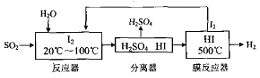
① 用化学方程式表示反应器中发生的反应___________。
② 在HI分解反应中使用膜反应器分离出H2的目的是__________。
③ 该工艺流程的优点有________。
(5)喷雾干燥法脱硫是除去SO2的常见方法,先将含SO2的废气溶于水,再用饱和石灰浆吸收,吸收液中c(Ca2+)一直保持为0.70mol/L,则吸收液中的c(SO42-)为_____。[已知该温度下,Ksp (CaSO3)=1.4×10-7]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列四组离子中一定能大量共存的是( )
A.K+、H+、Cl﹣、CO32﹣
B.Fe3+、Mg2+、NO3﹣、SCN﹣
C.NO3﹣ H+、Fe2+、SO42﹣
D.Na+、OH﹣、Cl﹣、NO3﹣
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com