
【题目】铬铁矿的主要成分可表示为FeO·Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,下图所示是以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的工艺流程。
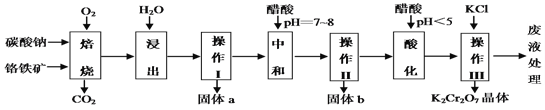
已知1:物质的溶解度(g/100g水)
物质 | 0℃ | 40℃ | 80℃ |
KCl | 28.0 | 40.1 | 51.3 |
NaCl | 35.7 | 36.4 | 38.0 |
K2Cr2O7 | 4.7 | 26.3 | 73.0 |
Na2Cr2O7 | 163.0 | 215.0 | 376.0 |
已知2:①焙烧时有Na2CrO4、 Fe2O3 、NaAlO2 等生成。
②Cr2O72- + H2O ![]() 2CrO42- + 2H+ ;
2CrO42- + 2H+ ;
③Cr2O72-具有很强的氧化性
回答问题:
(1)“浸出”步骤中,为了提高浸出率,可采取的措施有加热、研磨或_______________等(要求写一条)。
(2)固体b中主要含有______________________(填写化学式)。
(3)要检测酸化操作中溶液的pH是否等于4.5,应该使用_______(填写仪器或用品名称)。
(4)酸化步骤用醋酸调节溶液的pH﹤5,其目的是____________________;不用盐酸调节溶液pH的原因是______________________________________。
(5)操作III发生反应的化学方程式是____________________________ ;
(6)写出焙烧时生成NaAlO2的化学方程式____________________。
【答案】 搅拌 Al(OH)3 pH计或精密pH试纸 使CrO42-转化为Cr2O72- Cr2O72-会把盐酸(或氯离子)氧化为氯气 Na2Cr2O7 + 2KCl= K2Cr2O7 ↓+2NaCl Na2CO3 + Al2O3![]() NaAlO2+ CO2↑
NaAlO2+ CO2↑
【解析】铬铁矿的主要成分可表示为FeOCr2O3,还含有MgO、Al2O3、Fe2O3等杂质,加入氧气和碳酸钠,发生反应为:①4FeOCr2O3+8Na2CO3+7O2![]() 8Na2CrO4+2Fe2O3+8CO2↑;②Na2CO3+Al2O3
8Na2CrO4+2Fe2O3+8CO2↑;②Na2CO3+Al2O3![]() 2NaAlO2+CO2↑,因此铬铁矿通过焙烧,生成Na2CrO4、Fe2O3、MgO和NaAlO2的混合体系,然后加水溶解得固体Fe2O3、MgO和溶液Na2CrO4、NaAlO2,再调节溶液的pH,使偏铝酸盐完全沉淀,继续调节溶液的pH使CrO42-转化为Cr2O72-,最后向所得溶液中加入氯化钾,生成溶解度极小的K2Cr2O7。
2NaAlO2+CO2↑,因此铬铁矿通过焙烧,生成Na2CrO4、Fe2O3、MgO和NaAlO2的混合体系,然后加水溶解得固体Fe2O3、MgO和溶液Na2CrO4、NaAlO2,再调节溶液的pH,使偏铝酸盐完全沉淀,继续调节溶液的pH使CrO42-转化为Cr2O72-,最后向所得溶液中加入氯化钾,生成溶解度极小的K2Cr2O7。
(1)浸出”步骤中,为了提高浸出率,可采取的措施有加热,搅拌,研磨等加快反应速率,故答案为:搅拌;
(2)操作Ⅰ是过滤得到固体a为Fe2O3、MgO,操作Ⅱ是调节溶液的PH,使偏铝酸盐完全沉淀生成氢氧化铝,b为Al(OH)3,故答案为:Al(OH)3;
(3)要检测酸化操作中溶液的pH是否等于4.5,普通pH试纸只能测定溶液pH到整数,是近似测定,准确测定需要用pH计或精确pH试纸,故答案为:pH计或精密pH试纸;
(4)酸化步骤用醋酸调节溶液pH<5,依据流程图中物质的转化和制备目的可知,结合反应平衡Cr2O72-+H2O2CrO42-+2H+,加入酸,氢离子浓度增大,平衡左移,作用是使CrO42-转化为Cr2O72-,不用盐酸调节溶液pH的原因是重铬酸钾具有强氧化性能氧化氯离子为氯气,故答案为:使CrO42-转化为Cr2O72-;Cr2O72-会把盐酸(或氯离子)氧化为氯气;
(5)操作Ⅲ有多步组成,发生反应的化学方程式是Na2Cr2O7+2KCl=K2Cr2O7↓+2NaCl,故答案为:Na2Cr2O7+2KCl=K2Cr2O7↓+2NaCl;
(6)焙烧时生成NaAlO2的化学方程式为Na2CO3+Al2O3![]() 2NaAlO2+CO2↑,故答案为:Na2CO3+Al2O3
2NaAlO2+CO2↑,故答案为:Na2CO3+Al2O3![]() 2NaAlO2+CO2↑。
2NaAlO2+CO2↑。


科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A.晶体熔化时化学键一定发生断裂
B.原子晶体的熔点一定比金属晶体高
C.含有共价键的化合物一定是共价化合物
D.含有离子键的化合物一定是离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向2l恒温恒容容器中加入2molMgSO4并充入 2molCO,发生反应:MgSO4(s)+ CO(g)![]() MgO(s)+ CO2(g)+SO2(g)△H > 0 。测得反应过程中残留固体的质量随时间变化如图所示,下列说法不正确的是
MgO(s)+ CO2(g)+SO2(g)△H > 0 。测得反应过程中残留固体的质量随时间变化如图所示,下列说法不正确的是
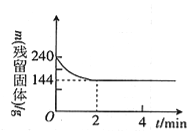
A. 0 ~2min内平均反应速率v(SO2)= 0.3 mol·l-1 ·min-1
B. 2 ~4min内容器内气体的密度没有变化
C. 该温度下,反应的平衡常数为1.8
D. 保持其他条件不变,起始时向容器中充入1.00 mol MgSO4和1.00 molCO,反应达到平衡时,n(CO2)> 0.60 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等量镁铝合金粉末分别投入到下列四种过量物质的溶液中,充分反应,放出H2最多的是
A. NaOH溶液 B. 稀H2SO4溶液
C. 蔗糖溶液 D. NaCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列四组物质,如果把某组物质中的后者逐滴加入到前者中至过量,将出现“先产生白色沉淀,后白色沉淀溶解”的现象,这组物质是
A. 稀硫酸、氯化钡溶液 B. 硫酸铝溶液、氨水
C. 氯化钠溶液、硝酸银溶液 D. 氯化铝溶液、氢氧化钠溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 甲烷和Cl2的反应与乙烯和Br2的反应属于同一有机反应类型
B. 单质硅是将太阳能转化为电能的常用材料
C. 淀粉、纤维素和油脂都属于天然高分子化合物
D. 合成纤维和光导纤维都是新型无机非金属材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)给定条件下的下列四种物质:①常温下112mL液态水,②含有40mol电子的NH3, ③含有16NA个共价键的乙醇,④4g氦气,则上述物质中所含分子数目由多到少的顺序是________________(填序号)。
(2)某混合气体只含有氧气和甲烷,在标准状况下,该气体的密度为1.00g/L,则该气体中氧气 和甲烷的体积比为________。
(3)标准状况下,VL氨气溶解在水中(水的密度近似为1g/mL),制成1L溶液,所得溶液密度为ρg/mL, 则所得溶液中溶质物质的量浓度是________ mol/L 。
(4)将100mLH2SO4和HCl混合溶液分成两等份,一份中加入含0.2molNaOH溶液时恰好中和完全,向另一份中加入含0.05molBaCl2溶液时恰好沉淀完全,则原溶液中c(Cl-)=_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com