
【题目】I. 钛被称为继铁、铝之后的第三金属,制备金属钛的一种流程如下:
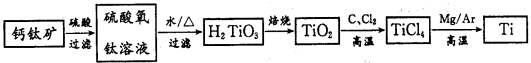
回答下列问题:
(1)已知TiCl4在通常情况下是无色液体,熔点为-37℃,沸点为136℃,可知TiCl4为___________晶体。
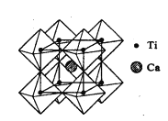
(2)钙钛矿晶体的结构如图所示。钛离子位于立方晶胞的角顶,被____个氧离子包围成配位八面体;钙离子位于立方晶胞的体心,被____个氧离子包围。
(3)纳米TiO2是一种应用广泛的催化剂,其催化的一个实例如下:
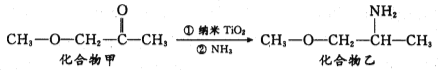
化合物甲中C原子的杂化方式为_______________;化合物乙的沸点明显高于化合物甲,主要原因是_______________________________。
II. 金属镍及其化合物在合金材料以及催化剂等方面应用广泛。请回答下列问题:
(4)镍元素在元素周期表中的位置为 。
(5)NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69 pm和78 pm,则熔点NiO________FeO(填“<”或“>”);
(6)甲醛(H2C=O)在Ni催化作用下加氢可得甲醇(CH3OH)。甲醇分子内的O—C—H键角______(填“大于”“等于”或“小于”)甲醛分子内的O—C—H键角。
(7)Ni的氯化物与氨水反应可形成配合物[Ni(NH3)4]Cl2,2mol该配合物中含有σ键______mol。
【答案】(1)分子 (2)6 12
(3)sp2和sp3 化合物乙分子间形成氢键
(4)第4周期第VIII族(5)> (6)小于(7)32
【解析】
试题分析:I.(1)TiCl4在通常情况下是无色液体,熔点为-37℃,沸点为136℃,可知TiCl4为分子晶体。
(2)根据钙钛矿晶体的结构知钛离子位于立方晶胞的角顶,被6个氧离子包围成配位八面体;钙离子位于立方晶胞的体心,被12个氧离子包围。
(3)根据有机物甲的结构简式知化合物甲中C原子的杂化方式为sp2、sp3;化合物乙的沸点明显高于化合物甲,主要原因是化合物乙分子间形成氢键。
II.(4)镍元素为28号元素,在元素周期表中的位置为第4周期第VIII族。
(5)NiO、FeO的晶体结构类型相似,离子半径:Ni2+<Fe2+,晶格能:NiO>FeO,则熔点NiO>FeO。
(6)甲醛(H2C=O)分子中碳原子的杂化方式为sp2杂化,甲醇(CH3OH)分子氧原子的杂化方式为sp3杂化,则甲醇分子内的O—C—H键角小于甲醛分子内的O—C—H键角。
(7)配合物[Ni(NH3)4]Cl2中含有14个σ键,则2mol该配合物中含有σ键28mol。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下表是实验室制备气体的有关内容:
编号 | 实验内容 | 实验原理 | 发生装置 |
① | 制氧气 | H2O2→O2 | |
② | 制氨气 | NH4Cl→NH3 | |
③ | 制氯气 | HCl→Cl2 |
(1)上述气体中:从制备过程看,必须选择合适的氧化剂才能实现的是______________(填气体的化学式,下同);从反应中有无电子转移的角度看,明显不同于其他气体的是___________,写出实验室制取该气体的化学方程式
(2)根据表中所列实验原理,从下列装置中选择合适的发生装置,将其编号填入上表的空格中。

(3) 若用上述制备O2的装置制备NH3,则选择的试剂为____________________。
(4) 制备Cl2需用8 mol/L的盐酸100mL,现用12 mol/L的盐酸来配制。
①需要12 mol/L的盐酸的体积为 mL(精确到0.1 mL)
②在容量瓶的使用方法中,下列操作不正确的是 (填写标号)。
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配溶液润洗
C.配制溶液时用量筒量取浓盐酸后用玻璃棒引流入容量瓶中,缓慢加入蒸馏水到接近标线1cm~2cm处,用胶头滴管滴加蒸馏水直到凹液面的最低处和标线相平
D.定容后盖好瓶塞,用食指顶住,用另一只手手指托住瓶底,把容量瓶倒转和摇动多次
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】脱羧反应形成新的C-C键,为有机合成提供了一条新的途径,例如:
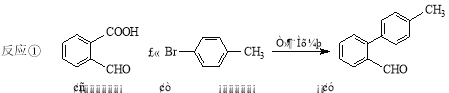
(1)写出化合物I含有的且能与H2发生加成反应的含氧官能团的名称 ,1 mol化合物I完全燃烧需要消耗 mol O2。
(2)化合物III与新制氢氧化铜悬浊液反应的化学方程式为________________________。
(3)化合物III分子中最多有 个原子共面。
(4)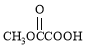 与
与![]() 也可以发生类似反应①的反应,有机产物的结构简式为:
也可以发生类似反应①的反应,有机产物的结构简式为:
。
(5)化合物I有多种同分异构体,请写出任意3种符合下列条件的同分异构体的结构简式:
_ ___。
(要求:①能与FeCl3溶液发生显色反应;②苯环上一氯取代产物有2种)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾是一种典型的强氧化剂。
完成下列填空:
Ⅰ.在用KMnO4酸性溶液处理Cu2S和CuS的混合物时,发生的反应如下:
①MnO+Cu2S+H+―→Cu2++SO2↑+Mn2++H2O(未配平)
②MnO+CuS+H+―→Cu2++SO2↑+Mn2++H2O(未配平)
(1)下列关于反应①的说法中错误的是______(填字母序号)。
a.被氧化的元素是Cu和S
b.氧化剂与还原剂的物质的量之比为85
c.生成2.24 L(标况下)SO2,转移电子的物质的量是0.8 mol
d.还原性的强弱关系是:Mn2+>Cu2S
Ⅱ.在稀硫酸中,MnO和H2O2也能发生氧化还原反应
氧化反应:H2O2-2e-===2H++O2↑
还原反应:MnO+5e-+8H+===Mn2++4H2O
(2)反应中若有0.5 mol H2O2参加此反应,转移电子的个数为________。
(3)已知:2KMnO4+7H2O2+3H2SO4===K2SO4+2MnSO4+6O2↑+10H2O,则被1 mol KMnO4氧化的H2O2是______mol。
Ⅲ.高锰酸钾溶液与硫化亚铁有如下反应:10FeS+6KMnO4+24H2SO4===3K2SO4+6MnSO4+5Fe2(SO4)3+10S+24H2O
(4)若上述反应前后固体的质量减少了2.8 g,则硫元素与KMnO4之间发生电子转移的数目为________个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活息息相关。下列说法正确的是( )
A.A12O3作耐火材料是因为氧化铝熔点高
B.医疗上,碳酸氢钠是治疗胃穿孔的一种药剂
C.铁在潮湿的空气中放置,易发生化学腐蚀而生锈
D.石英、水晶、水泥、光导纤维等物质的主要成分是SiO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.C60气化和干冰升华克服的作用力相同
B.分子晶体在水溶液中一定能导电
C.氯化钠和氯化氢溶于水时,破坏的化学键都是离子键
D.用作高温结构陶瓷材料的Si3N4固体是分子晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的说法正确的是( )
A.乙酸的分子式为CH3COOH,属于弱电解质
B.苯分子中没有碳碳双键,因此苯不能发生加成反应
C.交警用酸性重铬酸钾溶液检查司机是否饮酒过量时乙醇发生取代反应
D.乙烯能使酸性KMnO4溶液和溴水褪色,二者反应原理不相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某汽车安全气囊的产气药剂主要含有NaN3、Fe2O3、KClO4、NaHCO3等物质。当汽车发生碰撞时,产气药剂产生大量气体使气囊迅速膨胀,从而起到保护作用。
(1)NaN3是气体发生剂,受热分解产生N2和Na,N2的结构式为 。
(2)Fe2O3是主氧化剂,与Na反应生成的还原产物为 (已知该反应为置换反应),Fe2O3还可用于“铝热法”炼铁,铝热反应在冶金工业上可用于 。
(3)KClO4是助氧化剂,反应过程中与Na作用生成KCl和Na2O,Na2O的电子式为 。
(4)NaHCO3是冷却剂,吸收产气过程中释放的热量而发生分解,其化学方程式为:_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com