
Cu(NO3)2是重要的化工原料。回答下列工业生产和化学实验中的几个问题。
(1)实验室欲制备0.3 mol Cu (NO3)2晶体,甲、乙两同学分别设计实验方案如下:
甲:Cu 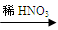 Cu(NO3)2 乙:Cu
Cu(NO3)2 乙:Cu 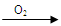 CuO
CuO 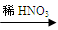 Cu(NO3)2
Cu(NO3)2
①从绿色化学的角度分析, 同学的方案更合理,此同学可节约2mol/L的稀硝酸 mL;
②乙同学实验时通入O2的速率不宜过大,为便于观察和控制产生O2的速率,宜选择
方案(填字母序号)。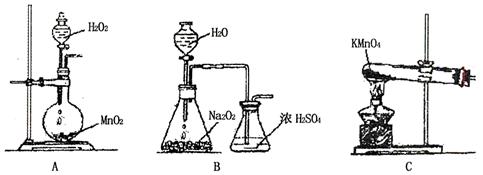
③有下述装置(如下图),当装置电路中通过2mol电子时,Cu电极(填编号) 。
(a)增重64g (b)减重64g (c)可能增重64g,也可能减重64g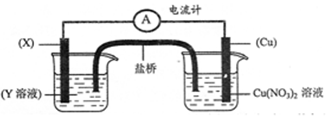
(2)①某校化学兴趣小组的同学对硝酸铜的受热分解进行探究。他们设计了如下图装置加热Cu(NO3)2固体(加热及夹持装置未画出)。加热过程发现:装置①中的固体逐渐变为黑色;装置②中有气泡产生,但在上升的过程中消失;石蕊试液逐渐变为红色,液体几乎不被压至装置③中。请写出Cu(NO3)2受热分解的化学方程式: ;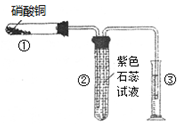
②在装置中①试管的橡皮塞最好用锡箔包住,原因是 。
(3)NO2、O2和熔融NaNO3可制作燃料电池,其原理见下图。该电池在使用过程中石墨I电极上生成氧化物Y,其电极反应式为 。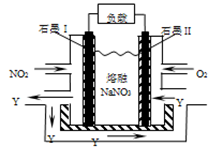
① 乙 (2分) 100 (1分) ② B (1分)
③ c (2分)
(2)① 2Cu(NO3)2 CuO+4NO2↑+O2↑ (2分,条件不写扣1分,未配平扣1分)
CuO+4NO2↑+O2↑ (2分,条件不写扣1分,未配平扣1分)
② NO2气体会腐蚀橡胶 (2分) [来源:学科网]
(3) NO2+NO3--e-=N2O5 (2分,未配平扣1分)
解析试题分析:铜与硝酸直接反应会产生二氧化氮气体,会污染环境,所以选乙装置,列出方程式,即可知道用乙可节约100ml.B装置容易控制反应的起始和终止,因此应该选择B装置。铜有可能做正极也有可能做负极所以铜电极可能增重64g,也可能减重64g。Cu(NO3)2受热分解的化学方程式2Cu(NO3)2 CuO+4NO2↑+O2↑,在装置中①试管的橡皮塞最好用锡箔包住,原因是NO2气体会腐蚀橡胶。在燃料电池中,燃料做负极,氧气做正极。所以电极反应式为NO2+NO3--e-=N2O5
CuO+4NO2↑+O2↑,在装置中①试管的橡皮塞最好用锡箔包住,原因是NO2气体会腐蚀橡胶。在燃料电池中,燃料做负极,氧气做正极。所以电极反应式为NO2+NO3--e-=N2O5
考点:考查实验的基本装置以及原电池的相关知识点


 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源: 题型:单选题
下列关于铝及其化合物的说法不正确的是
| A.Al既可用于食品包装,也可用做建筑材料 |
| B.Al2O3既可用来冶炼金属Al,也可用做耐火材料 |
| C.明矾[KAl(SO4)2·12H2O]既可用做净水剂,也可用作消毒剂 |
| D.Al(OH)3既可用作治疗胃酸过多的药物,也可用来制备一些铝盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知X、Y中含有相同的元素,Z、W中也含有相同的元素,根据反应X+H2O Y+H2
Y+H2 ↑;Z+H2O
↑;Z+H2O W+O2↑(方程式均未配平),可推断X、Y中及Z、W中相同元素的化合价的高低顺序为( )
W+O2↑(方程式均未配平),可推断X、Y中及Z、W中相同元素的化合价的高低顺序为( )
| A.X>Y Z>W | B.X<Y Z<W |
| C.X>Y Z<W | D.X<Y Z>W |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
为了测定氢氧化钠和碳酸钠固体混合物中碳酸钠的质量分数,甲、乙两位同学分别设计了如下的实验方案:
(I)甲同学的方案是:将mg样品溶解,加过量氯化钡溶液,过滤、洗涤、烘干,称得固体ng。
(1)混合物中碳酸钠的质量分数为(用m、n表示) ,甲同学洗涤沉淀的具体操作是 。
(2)Ca2+、Ba2+都可以使CO32-沉淀完全,但使用氯化钡溶液比氯化钙溶液所得的结果具有更高的精确度,原因是:① ;
② 。
(Ⅱ)乙同学的方案如图所示: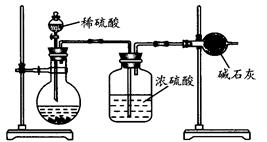
(1)根据乙同学的实验装置图分析,在每次实验中,完成测定过程至少要进行 次称量操作。按照该同学的方案进行测定,结果与实际情况存在较大的误差,你认为主要原因可能是(任写两个):
① ;
② 。
(2)乙同学的方案的装置中存在一定的缺陷,请你提出改进的方法(简单叙述做法,不必画图): 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(10分) 现有金属单质A、B、C和气体甲、丙以及物质D、E、F、G、H,它们之间的相互转化关系如下图所示(图中有些反应的生成物和反应的条件没有标出)。
请回答下列问题:
(1)写出下列物质的化学式:B 、丙
(2)写出下列反应的化学方程式:
反应① ;反应③ ;
反应⑥ 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(14分)已知:A为含金属离子的淡黄色固体化台物,E、X为空气中常见气体,A、B、C、D含有相同的金属离子,其转化关系如下图(部分产物已略去)。
请回答下列问题
(1)这种金属离子的离子结构示意图为_____________;
(2)X的电子式_______________;
(3)B中所含化学键的类型是_____________;
常温常压下,7.8gA与足量的水充分反应放出热量a kJ,写出该反应的热化学方程式
_________________________________________________________________.
(4)①C也可转化为B,写出该转化的化学方程式_______________________________;
②B与D反应的离子方程式为_______________________________________.
(5)将一定量的气体X通入2LB的溶液中,向所得溶液中边逐滴加入稀盐酸边振荡至过量,产生的气体与盐酸物质的量的关系如图(忽略气体的溶解和HCl的挥发)。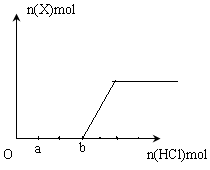
请回答:a点溶液中所含溶质的化学式为__________ ,a-b之间的反应的离子方程式是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D都是中学化学常见的物质,其中A、B、C均含有同一种元素。在一定条件下相互转化的关系如图所示(部分反应中的H2O已略去)。请按要求回答下列问题:
(1)若D为金属单质,且D是用量最大、用途最广的金属,若加热蒸干B的溶液没有得到B的盐,则B的化学式可能为__________________________。
(2)若A常用作制冷剂,B和D为空气的主要成分,则反应(Ⅲ) 的化学方程式为______________。
(3)若D为氯碱工业的重要产品,反应(Ⅲ)的离子方程式可以是_________________________。
(4)若D为酸或酸性气体,则A、B、C、D可以是________________(请按顺序写出合理的答案)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(15分)硬质玻璃管是化学实验中经常使用的一种仪器,请分析下列实验(固定装置略)并回答问题。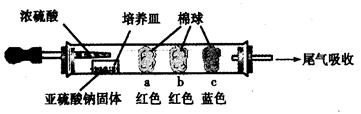
Ⅰ、进行微量实验:如图所示,将浓硫酸滴入装有Na2SO3固体的培养皿一段时间后,a、b、c三个棉球变化如下表。请填写表中的空白:
| 棉球 | 棉球上滴加的试剂 | 实验现象 | 解释和结论 |
| a | | 棉球变白,微热后又恢复红色 | |
| b | 含酚酞的NaOH溶液 | 棉球变为白色 | 离子方程式: |
| c | | 棉球变为白色 | 该气体具有 (选填“氧化性”或“还原性”) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
欲测定含少量氯化钠的小苏打固态样品中NaHCO3的质量分数可采用以下四种方法。
方法一:
方法二: 
方法三:
方法四:不使用化学试剂,使用实验室常用仪器
按要求回答下列问题:
(1)方法一:加入足量的试剂A (填写A的化学式)可将HCO3-离子转化为沉淀并称重。操作1、2、3、4的名称依次是溶解、 、洗涤和 ;
(2)方法二:在操作1中所用到的玻璃仪器中,除了烧杯、玻璃棒、胶头滴管外,还需要的用到的是 ,在操作2中应选择的指示剂是 ;
(3)在方法二中计算该样品中NaHCO3的质量分数为 [用流程图中的数据m、V(HCl) 填写有关的表达式];
(4)在方法三中:根据所用的实验装置,除了称量试样质量外,还需测定的实验数据是 ;
(5)仔细分析方法三中的实验装置,若由此测得的数据来计算实验结果,则有可能偏高也有可能偏低,偏高的原因可能是 ,偏低的原因可能是 (均文字简述);
(6)方法四的实验原理是: (用化学方程式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com