
【题目】某溶液只含有Na+、 Fe3+、Cl-、SO42-4种离子,已知溶液中Na+、Fe3+、Cl-的个数之比为3:2:1。则溶液中Fe3+和SO42-的个数之比为:
A.3:4B.1:4C.1:2D.3:2
 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源: 题型:
【题目】某化学兴趣小组利用如图装置进行铁与水蒸气反应的实验,并检验产物的性质,请回答下列问题:
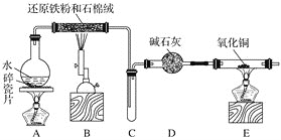
(1)A装置的作用是____________,烧瓶底部放碎瓷片的作用是_________________________。
(2)装置B中发生反应的化学方程式是____________________________________,该反应中氧化剂是__________,氧化产物是__________________。
(3)D的作用是__________________________________。
(4)E中的实验现象是____________________________。
(5)A、B两个装置中应先点燃________________处的酒精(喷)灯,点燃E处酒精灯之前应进行的操作是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关Na2CO3和NaHCO3的性质说法正确的是
A. 溶解度:Na2CO3>NaHCO3
B. 右图所示装置可证明稳定性:Na2CO3>NaHCO3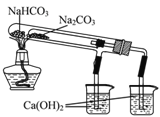
C. 用澄清石灰水可鉴别Na2CO3溶液和NaHCO3溶液
D. 等质量的Na2CO3和NaHCO3分别与过量盐酸反应,放CO2质量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是过氧化氢(H2O2)分子的空间结构示意图。
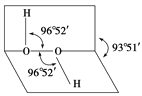
(1)写出过氧化氢分子的电子式________。
(2)下列关于过氧化氢的说法中正确的是(填序号)____。
①分子中有极性键 ②分子中有非极性键 ③氧原子的轨道发生了sp2杂化 ④O—O共价键是p—pσ键 ⑤分子是非极性分子
(3)过氧化氢分子之间易形成氢键,该氢键的表示式是____________。
(4)过氧化氢难溶于二硫化碳,主要原因是______________________;过氧化氢易溶于水,主要原因是________________________。
(5)过氧乙酸也是一种过氧化物,它可以看作是过氧化氢分子中的一个氢原子被乙酰基(CH3CO)取代的产物,是一种常用的杀菌消毒剂。在酸性条件下过氧乙酸易发生水解反应生成过氧化氢。
①写出过氧乙酸发生水解反应的化学方程式(有机物用结构简式表示):____________。
②过氧乙酸用作杀菌消毒剂的原因是________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物NH3与BF3可以通过配位键形成NH3·BF3。
(1)配位键的形成条件是_________________________________。
(2)在NH3·BF3中,________原子提供孤对电子,________原子接受电子。
(3)写出NH3·BF3的电子式并用“→”标出配位键。______________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】B元素和N元素对植物生长及人体健康有着十分重要的作用,也广泛应用于新型材料的制备。
(1)基态氮原子的外围电子排布图为________________;晶体硼单质的基本结构单元为正二十面体,其能自发地呈现多面体外形,这种性质称为晶体的__________________性。
(2)氨硼烷(NH3BH3)被认为是最具潜力的新型储氢材料之一,与氨硼烷互为等电子体的分子、离子的化学式分别是______________、________________。 (各举一例),第二周期元素中第一电离能介于B和N之间的元素是______________(填元素符号)。
(3)血红素是吡咯(C4H5N)的重要衍生物,血红素(含Fe2+)可用于治疗缺铁性贫血。吡咯和血红素的结构如下图:

①己知吡咯中的各个原子均在同一平面内;则吡咯分子中N原子的杂化类型为________________。
②1mol吡咯分子中所含的σ键总数为__________个;分子中的大π键可用Π![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则吡咯环中的大π键应表示为____________。
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则吡咯环中的大π键应表示为____________。
③C、N、O三种元素的简单氢化物键角由小到大的顺序为_____________(填化学式),原因是__________________。
④血液中的O2是由血红素在人体内形成的血红蛋白来输送的,则血红蛋白中的Fe2+与O2是通过___________键相结合。
(4)氮化硼(BN)是受高度关注的耐磨材料,可作为金属表面的保护层,其结构与金刚石类似,晶胞结构如图所示。已知该晶体密度为ag/cm3,根据硬球接触模型计算晶体中两个最近的N原子间的距离为:_________pm。(用含a的代数式表示,NA表示阿伏加德罗常数)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸镁可用于牙膏、医药和化妆品等工业,化学式为,Mg(OH)24MgCO35H2O某碱式碳酸镁中含有SiO2杂质,为测定其纯度,某兴趣小组设计了如下几个方案:
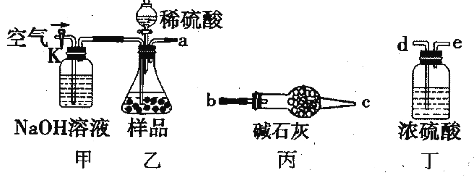
方案Ⅰ
取一定质量的样品,与硫酸充分反应,通过测定生成CO2的质量计算纯度
(1)乙中发生反应的方程式为____________________________。
(2)仪器接口的连接顺序为(装置可以重复使用)a________ ,丁的作用是____________。
(3)关闭止水夹K,向样品中加入足量的稀硫酸,当样品充分反应完后,为了测定准确还应进行的操作是__________________________。
方案Ⅱ
①称取碱式碳酸镁样品m克;②将样品充分高温煅烧,冷却后称量;③重复操作②,测得剩余固体质量为m1克。
(4)下列仪器中,该方案不会用到的是______________________。
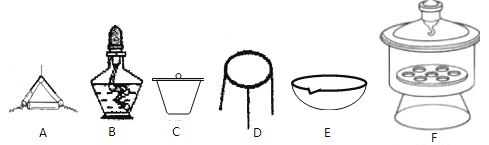
(5)判断样品完全分解的方法是_______________________。
(6)有同学认为方案Ⅱ高温煅烧的过程中会发生MgCO3+SiO2 ![]() MgSiO3+CO2,会导致测定结果有误,你认为这位同学的观点正确吗?________________________(填“正确”或“错误”)请说明自己的理由:_______________________________________________。
MgSiO3+CO2,会导致测定结果有误,你认为这位同学的观点正确吗?________________________(填“正确”或“错误”)请说明自己的理由:_______________________________________________。
(7)求碱式碳酸镁的纯度_______________________(用含有m,m1的式子表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物N是制备某药品的中间体,其合成路线如下(部分产物和条件已略):

已知:RCN![]() RCOOH
RCOOH![]() RCOCl
RCOCl![]() RCOOR'
RCOOR'
请按要求回答下列问题:
(1)已知A标准状况下的密度为1.25g/L,则A的结构简式为_______;其分子共平面的原子数目为____________。
(2)B的官能团名称为________。反应①的反应类型为_______。F的名称为_______ 。
(3)P是比A相对分子质量大28的同系物,P的所有可能的结构(含p)数目为______。写出P的属于环烃的同分异构体的结构简式: ______ 。
(4)写出反应②的化学方程式: ______。
(5)已知:  。參照上述流程,设计以G为原料制备K的合成路线(无机试剂任选):_______________。
。參照上述流程,设计以G为原料制备K的合成路线(无机试剂任选):_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com