
【题目】化合物NH3与BF3可以通过配位键形成NH3·BF3。
(1)配位键的形成条件是_________________________________。
(2)在NH3·BF3中,________原子提供孤对电子,________原子接受电子。
(3)写出NH3·BF3的电子式并用“→”标出配位键。______________________________________
 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:
【题目】有关晶体的结构如图所示,下列说法中不正确的是 ( )


A. 在NaCl晶体中,距Na+最近的Cl-形成正八面体
B. 在CaF2晶体中,每个晶胞平均占有4个Ca2+
C. 在金刚石晶体中,碳原子与碳碳键个数的比为1∶2
D. 该气态团簇分子的分子式为EF或FE
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧化锌及氧化锌都是重要的含锌化合物。氢氧化锌是难溶于水的白色固体,在水中的电离形式与Al(OH)3相似。常温下,水溶液中不同形式含锌微粒物质的量浓度(对数值lgc)与pH的关系如下图所示。回答下列问题:

(1)向ZnCl2溶液中滴加NaOH溶液至过量,看到的现象是___________________________;实验室中若用Zn、NaOH溶液和稀盐酸制备Zn(OH)2,最佳方案是______________________。
(2)根据图中数据可知,常温下,Ksp[Zn(OH)2]=_________。
(3)工业上可用菱锌矿(主要成分是ZnCO3,还含有少量的Fe2O3、FeO、CuO等杂质)为原料制取氧化锌。工艺流程如下:

①氧化锌是__________(填“酸性”或“碱性”或“两性”)氧化物。上述流程中,“试剂甲”参与反应的离子方程式为______________________________________。
②可以利用碳酸锌代替氨水来调节溶液的pH并得到氢氧化铁沉淀,原因是________;若“乙溶液”中c(Fe3+)为2.6×10-18mol/L,则c(Zn2+)为______mol/L(已知:Ksp[Fe(OH)3]=2.6×10-39)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】判断含氧酸酸性强弱的一条经验规律是:含氧酸分子结构中含非羟基氧原子数越多,该含氧酸的酸性越强。如下表所示:
含氧酸酸性强弱与非羟基氧原子数的关系
次氯酸 | 磷酸 | 硫酸 | 高氯酸 | |
含氧酸 | Cl—OH |
|
|
|
非羟基氧原子数 | 0 | 1 | 2 | 3 |
酸性 | 弱酸 | 中强酸 | 强酸 | 最强酸 |
(1)亚磷酸H3PO3和亚砷酸H3AsO3分子式相似,但它们的酸性强弱相差很大,H3PO3是中强酸,H3AsO3既有弱酸性又有弱碱性。由此可知它们的结构式分别为①__________,②__________。
(2)H3PO3和H3AsO3与过量的NaOH溶液反应的化学方程式分别是①__________,②__________。
(3)在H3PO3和H3AsO3中分别加入浓盐酸,分析反应情况__________,写出反应的化学方程式________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组研究溶液中Fe2+与NO2-、NO3-的反应。
实验I | 试剂 | 现象 | |
滴管 | 试管 | ||
2mL | 1 mol·L-1FeSO4溶液(pH=4) | 1 mol·L-1 NaNO2溶液(pH=8) | a.滴入1滴FeSO4溶液,溶液变黄色,继续滴加,溶液变为棕色。2小时后,无明显变化 |
1 mol·L-1NaNO3溶液(加NaOH溶液至pH=8) | b.持续滴加FeSO4溶液,无明显变化。 | ||
资料:[Fe(NO)]2+在溶液中呈棕色。[Fe(NO)]2+![]() Fe2++NO。
Fe2++NO。
(1)研究现象a中的黄色溶液。
①用______溶液(填试剂名称)检出溶液中含有Fe3+。
②甲认为是O2氧化了溶液中的Fe2+。乙认为O2不是主要原因,理由是________________________。
③进行实验Ⅱ,装置如图。证实了Fe2+被NO2-氧化为Fe3+。装置左侧烧杯中的试剂为:______________,实验过程中右侧电极上产生无色气泡,电极反应式为_____________________,左侧烧杯中的现象为:_____________________。
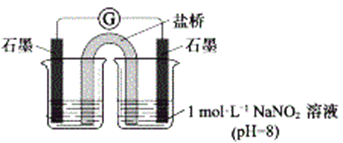
(2)研究现象a中的棕色溶液。
①综合实验Ⅰ和实验Ⅱ,提出假设:现象a中溶液变为棕色可能是NO与溶液中的Fe2+或Fe3+发生了反应。进行实验Ⅲ,证实溶液呈棕色只是因为Fe2+与NO发生了反应。实验Ⅲ的操作和现象是____________________________________________。
②加热实验Ⅰ中的棕色溶液,有气体逸出,该气体在接近试管口处变为红棕色,溶液中有红褐色沉淀生成。解释产生红褐色沉淀的原因是________________________________________。
(3)研究酸性条件下,溶液中Fe2+与NO2-、NO3-的反应。
序号 | 操作 | 现象 |
ⅰ | 取1 mol·L-1的NaNO2溶液,加醋酸至pH=3,加入1 mol·L-1FeSO4溶液 | 溶液立即变为棕色 |
ⅱ | 取1 mol·L-1的NaNO3溶液,加醋酸至pH=3,加入1 mol·L-1FeSO4溶液 | 无明显变化 |
ⅲ | 分别取0.5 mL 1 mol·L-1的NaNO3溶液与1 mol·L-1的FeSO4溶液,混合,小心加入0.5 mL浓硫酸 | 液体分为两层,稍后,在两层液体界面上出现棕色环 |
①ⅰ中溶液变为棕色的离子方程式是____________________________、Fe2++NO =[Fe(NO)]2+。
②ⅲ中出现棕色的原因是________________________________。
实验结论:本实验条件下,溶液中NO2、NO3的氧化性与溶液的酸碱性等有关。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液只含有Na+、 Fe3+、Cl-、SO42-4种离子,已知溶液中Na+、Fe3+、Cl-的个数之比为3:2:1。则溶液中Fe3+和SO42-的个数之比为:
A.3:4B.1:4C.1:2D.3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅精矿可用于冶炼金属铅,其主要成分为PbS。
I.火法炼铅将铅精矿在空气中焙烧,生成PbO和SO2。
(1)用铅精矿火法炼铅的反应的化学方程式为___________________________。
(2)火法炼铅的废气中含低浓度SO2,可将废气通入过量氨水中进行处理,反应的离子方程式为__________________________________________________。
II.湿法炼铅在制备金属铅的同时,还可制得硫磺,相对于火法炼铅更为环保。湿法炼铅的工艺流程如下:
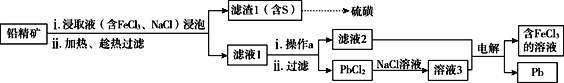
已知:①不同温度下PbCl2的溶解度如下表所示。
温度(℃) | 20 | 40 | 60 | 80 | 100 |
溶解(g) | 1.00 | 1.42 | 1.94 | 2.88 | 3.20 |
②PbCl2为能溶于水的弱电解质,在Cl-浓度较大的溶液中,存在平衡:PbCl2(aq)+2Cl-(aq)![]() PbCl42-(aq)
PbCl42-(aq)
(3)浸取液中FeCl3的作用是___________________________。
(4)操作a为加适量水稀释并冷却,该操作有利于滤液1中PbCl2的析出,分析可能的原因是____________________________________。
(5)将溶液3和滤液2分别置于如图所示电解装置的两个极室中,可制取金属铅并使浸取液中的FeCl3再生。
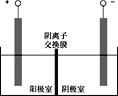
①溶液3应置于_______________(填“阴极室”或“阳极室”)中。
②简述滤液2电解后再生为FeCl3的原理:_____________________。
③若铅精矿的质量为a g,铅浸出率为b ,当电解池中通过c mol电子时,金属铅全部析出,铅精矿中PbS的质量分数的计算式 为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在无色强酸性溶液中,下列各组离子能够大量共存的是
A. Al3+、Fe2+、Cl-、SO42-B. NH4+、HCO3-、Cl-、K+
C. Na+、Ba2+、NO3-、SO42-D. Cl -、Na+、NO3-、Ca2+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com