
【题目】在无色强酸性溶液中,下列各组离子能够大量共存的是
A. Al3+、Fe2+、Cl-、SO42-B. NH4+、HCO3-、Cl-、K+
C. Na+、Ba2+、NO3-、SO42-D. Cl -、Na+、NO3-、Ca2+
科目:高中化学 来源: 题型:
【题目】化合物NH3与BF3可以通过配位键形成NH3·BF3。
(1)配位键的形成条件是_________________________________。
(2)在NH3·BF3中,________原子提供孤对电子,________原子接受电子。
(3)写出NH3·BF3的电子式并用“→”标出配位键。______________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】符合如图所示的转化关系,且当X、Y、Z的物质的量相等时,存在焓变△H=△H1+△H2。满足上述条件的X、Y可能是

①C、CO ②S、SO2 ③Na、Na2O ④AlCl3、Al(OH)3 ⑤Fe、Fe(NO3)2 ⑥NaOH、Na2CO3
A. ①④⑤ B. ①②③ C. ①③④ D. ①③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示。则下列离子组在对应的溶液中一定能大量共存的是
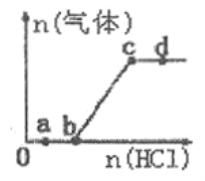
A. a点对应的溶液中:Na+、Ca2+、SO42-、NO3-
B. b点对应的溶液中:K+、Na+、OH-、Cl-
C. c点对应的溶液中: Na+、Ca2+、NO3-、Cl-
D. d点对应的溶液中: Cl-、NO3-、Fe2+、Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,第一种是酸,第二种是混合物,第三种是碱的是
A. 空气、硫酸铜、硫酸B. 醋酸、液氯、纯碱
C. 硝酸、食盐水、烧碱D. 氧化铁、胆矾、熟石灰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物N是制备某药品的中间体,其合成路线如下(部分产物和条件已略):

已知:RCN![]() RCOOH
RCOOH![]() RCOCl
RCOCl![]() RCOOR'
RCOOR'
请按要求回答下列问题:
(1)已知A标准状况下的密度为1.25g/L,则A的结构简式为_______;其分子共平面的原子数目为____________。
(2)B的官能团名称为________。反应①的反应类型为_______。F的名称为_______ 。
(3)P是比A相对分子质量大28的同系物,P的所有可能的结构(含p)数目为______。写出P的属于环烃的同分异构体的结构简式: ______ 。
(4)写出反应②的化学方程式: ______。
(5)已知:  。參照上述流程,设计以G为原料制备K的合成路线(无机试剂任选):_______________。
。參照上述流程,设计以G为原料制备K的合成路线(无机试剂任选):_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂。请填写下列空白:
(1)下图中______(填“A”或“B”)是碱式滴定管,进行该实验的第一步操作是____________________。
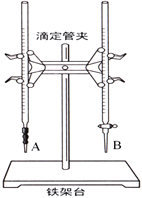
(2)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视锥形瓶中溶液颜色变化,直到因加入一滴盐酸后,出现_____________________________(填“现象”)说明达到滴定终点。
(3)下列操作中可能使所测NaOH溶液的浓度数值偏低的是(____)
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
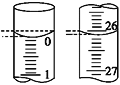
(4)若滴定开始和结束时,酸式滴定管中的液面如图所示,则所用盐酸溶液的体积为________mL。
(5)某学生根据3次实验分别记录有关数据如下表:
滴定次数 待测NaOH溶液的体积/mL | 0.100 0 mol·L-1盐酸的体积/mL | ||
滴定前刻度 | 滴定后刻度 | ||
第一次 | 25.00 | 0.00 | 26.11 |
第二次 | 25.00 | 1.56 | 30.30 |
第三次 | 25.00 | 0.22 | 26.31 |
依据上表数据列式计算该NaOH溶液的物质的量浓度(写出简要过程)。______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷(As)是一些工厂和矿山废水中的污染元素。常温下,H3AsO4水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与加NaOH溶液调节pH的关系如图所示(已知:pKa=-lgKa),下列说法错误的是
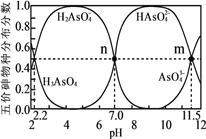
A. Na2HAsO4溶液显碱性
B. H3AsO4溶液pKa2为2.2
C. m点对应溶液中由水电离出的c(OH-)为10-2.5mol·L-1
D. n点对应溶液中离子浓度关系为:c(Na+)>c(HAsO42-)=c(H2AsO4-)>c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)R单质的晶体在不同温度下有两种原子堆积方式,晶胞分别如下图所示。A中原子堆积方式为________堆积,A、B中R原子的配位数之比为________。
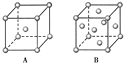
(2)已知单质D为面心立方晶体,如图所示,D的相对原子质量为M,密度为8.9 g/cm3。

试求:
①图中正方形边长=________cm(只列出计算式,NA表示阿伏加德罗常数的值)。
②试计算单质D晶体中原子的空间利用率:________(列出计算式并化简)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com