
【题目】下列各组物质中,第一种是酸,第二种是混合物,第三种是碱的是
A. 空气、硫酸铜、硫酸B. 醋酸、液氯、纯碱
C. 硝酸、食盐水、烧碱D. 氧化铁、胆矾、熟石灰
科目:高中化学 来源: 题型:
【题目】某小组研究溶液中Fe2+与NO2-、NO3-的反应。
实验I | 试剂 | 现象 | |
滴管 | 试管 | ||
2mL | 1 mol·L-1FeSO4溶液(pH=4) | 1 mol·L-1 NaNO2溶液(pH=8) | a.滴入1滴FeSO4溶液,溶液变黄色,继续滴加,溶液变为棕色。2小时后,无明显变化 |
1 mol·L-1NaNO3溶液(加NaOH溶液至pH=8) | b.持续滴加FeSO4溶液,无明显变化。 | ||
资料:[Fe(NO)]2+在溶液中呈棕色。[Fe(NO)]2+![]() Fe2++NO。
Fe2++NO。
(1)研究现象a中的黄色溶液。
①用______溶液(填试剂名称)检出溶液中含有Fe3+。
②甲认为是O2氧化了溶液中的Fe2+。乙认为O2不是主要原因,理由是________________________。
③进行实验Ⅱ,装置如图。证实了Fe2+被NO2-氧化为Fe3+。装置左侧烧杯中的试剂为:______________,实验过程中右侧电极上产生无色气泡,电极反应式为_____________________,左侧烧杯中的现象为:_____________________。
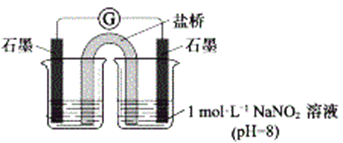
(2)研究现象a中的棕色溶液。
①综合实验Ⅰ和实验Ⅱ,提出假设:现象a中溶液变为棕色可能是NO与溶液中的Fe2+或Fe3+发生了反应。进行实验Ⅲ,证实溶液呈棕色只是因为Fe2+与NO发生了反应。实验Ⅲ的操作和现象是____________________________________________。
②加热实验Ⅰ中的棕色溶液,有气体逸出,该气体在接近试管口处变为红棕色,溶液中有红褐色沉淀生成。解释产生红褐色沉淀的原因是________________________________________。
(3)研究酸性条件下,溶液中Fe2+与NO2-、NO3-的反应。
序号 | 操作 | 现象 |
ⅰ | 取1 mol·L-1的NaNO2溶液,加醋酸至pH=3,加入1 mol·L-1FeSO4溶液 | 溶液立即变为棕色 |
ⅱ | 取1 mol·L-1的NaNO3溶液,加醋酸至pH=3,加入1 mol·L-1FeSO4溶液 | 无明显变化 |
ⅲ | 分别取0.5 mL 1 mol·L-1的NaNO3溶液与1 mol·L-1的FeSO4溶液,混合,小心加入0.5 mL浓硫酸 | 液体分为两层,稍后,在两层液体界面上出现棕色环 |
①ⅰ中溶液变为棕色的离子方程式是____________________________、Fe2++NO =[Fe(NO)]2+。
②ⅲ中出现棕色的原因是________________________________。
实验结论:本实验条件下,溶液中NO2、NO3的氧化性与溶液的酸碱性等有关。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某物质灼烧焰色反应为黄色,下列判断正确的是( )
A.该物质一定是钠的化合物B.该物质一定含钠离子
C.该物质一定是金属钠D.不能确定该物质是否含钾元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将100 mL 2 mol/L AlCl3溶液跟一定体积4 mol/L NaOH溶液混合后可得7.8 g沉淀,则NaOH溶液的体积可能是:①75 mL ②150 mL ③175 mL ④200 mL
A. ① B. ② C. ①③ D. ②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,CH4与H2O(g)发生反应:CH4(g)+H2O(g)![]() CO(g)+3H2(g),设起始
CO(g)+3H2(g),设起始![]() =Z,在恒压下,平衡时
=Z,在恒压下,平衡时![]() (CH4)的体积分数与Z和T(温度)的关系如图所示。下列说法正确的是
(CH4)的体积分数与Z和T(温度)的关系如图所示。下列说法正确的是
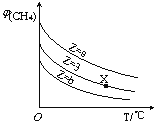
A.该反应的焓变△H>0
B.图中Z的大小为a>3>b
C.图中X点对应的平衡混合物中![]() =3
=3
D.温度不变时,图中X点对应的平衡在加压后![]() (CH4)减小
(CH4)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在无色强酸性溶液中,下列各组离子能够大量共存的是
A. Al3+、Fe2+、Cl-、SO42-B. NH4+、HCO3-、Cl-、K+
C. Na+、Ba2+、NO3-、SO42-D. Cl -、Na+、NO3-、Ca2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用漂白粉溶液浸泡过的有色布条,如晾晒在空气中,过一段时间,其漂白效果更好的原因是( )
A.漂白粉被氧化了
B.漂白粉和空气中的二氧化碳充分反应生成了次氯酸
C.有色布条被空气中的氧气氧化
D.漂白粉溶液失去了部分水分,浓度增大了
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2008年北京残奥会吉祥物是以牛为形象设计的“福牛乐乐”(Funiulele),如图甲。有一种有机物的键线式也酷似牛,故称为牛式二烯炔醇(cowenynenyonl),如图乙。已知连有四个不同的原子或原子团的碳原子,称为手性碳原子。下列有关说法不正确的是( )
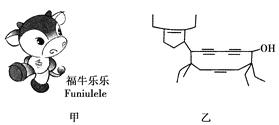
A. 牛式二烯炔醇含有三种官能团
B. 牛式二烯炔醇含有三个手性碳原子
C. 1 mol 牛式二烯炔醇最多可与6 mol Br2发生加成反应
D. 牛式二烯炔醇分子内能发生消去反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钒(23V)是我国的丰产元素,广泛用于催化及钢铁工业。回答下列问题:
(1)钒在元素周期表中的位置为_______,其价层电子排布图为____________。
(2)钒的某种氧化物的晶胞结构如图1所示。晶胞中实际拥有的阴、阳离子个数分别为____、_____。
(3)V2O5常用作SO2转化为SO3的催化剂。SO2分子中S原子价层电子对数是__对,分子的立体构型为___;SO3气态为单分子,该分子中S原子的杂化轨道类型为____;SO3的三聚体环状结构如图2所示,该结构中S原子的杂化轨道类型为___;该结构中S—O键长有两类,一类键长约140pm,另一类键长约为160pm,较短的键为__(填图2中字母),该分子中含有___个σ键。

(4)V2O5溶解在NaOH溶液中,可得到钒酸钠(Na3VO4),该盐阴离子的立体构型为___;也可以得到偏钒酸钠,其阴离子呈如图3所示的无限链状结构,则偏钒酸钠的化学式为_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com