
����Ŀ��������п������п������Ҫ�ĺ�п�����������п��������ˮ�İ�ɫ���壬��ˮ�еĵ�����ʽ��Al(OH)3���ơ������£�ˮ��Һ�в�ͬ��ʽ��п�����ʵ���Ũ��(����ֵlgc)��pH�Ĺ�ϵ����ͼ��ʾ���ش��������⣺

(1)��ZnCl2��Һ�еμ�NaOH��Һ��������������������___________________________��ʵ����������Zn��NaOH��Һ��ϡ�����Ʊ�Zn(OH)2����ѷ�����______________________��
(2)����ͼ�����ݿ�֪�������£�Ksp[Zn(OH)2]=_________��
(3)��ҵ�Ͽ�����п��(��Ҫ�ɷ���ZnCO3��������������Fe2O3��FeO��CuO������)Ϊԭ����ȡ����п�������������£�

������п��__________(������������������������������)��������������У����Լ��������뷴Ӧ�����ӷ���ʽΪ______________________________________��
����������̼��п���氱ˮ��������Һ��pH���õ���������������ԭ����________����������Һ����c(Fe3+)Ϊ2.6��10-18mol/L����c(Zn2+)Ϊ______mol/L(��֪��Ksp[Fe(OH)3]=2.6��10-39)��
���𰸡� �Ȳ�����ɫ��������ɫ�������ܽ� ��Zn��Ϊ���ȷݣ��ֱ����NaOH��Һ�����ᣬʹ��ǡ���ܽ⣬Ȼ��������Һ��ϣ�����Zn(OH)2 1.0��10-17 ���� 2Fe2++H2O2+2H+=2Fe3++2H2O��2Fe2++H2O2+4NH3��H2O=2Fe(OH)3��+4NH4+ ZnCO3����H+��Ӧ��������ҺpH�����ã�ͬʱʹFe3+��ˮ��ƽ�������ƶ������������������� 1.0��10-3
����������1����ͼʾ�õ������������ӹ�����ʱ��������пӦ��ת��ΪZn(OH)42-�����Կ��������������а�ɫ�������ܽ����Ʊ�������п�Ĺ��̿��Բο������������Ʊ������Ƶõ�����Al3+��Al(OH)4-�ٷ���˫ˮ�ⷴӦ������������ȡ������п�ķ���Ϊ����Zn��Ϊ���ȷݣ��ֱ����NaOH��Һ�����ᣬʹ��ǡ���ܽ⣬Ȼ��������Һ��ϣ�����Zn(OH)2��
��2����ͼʾpH=7��ʱ��Zn2+Ϊ1��10-3mol/L������������п��KSP=1��10-3��(1��10-7)2=1.0��10-17��
��3���ٸ��ݣ�1���ķ�����������пӦ�������������������ZnO������������Լ��������ǽ�Fe2+����ΪFe3+��Ӧ��ʹ�ù���������������ɫ�����������Է���ʽΪ��2Fe2++H2O2+2H+=2Fe3++2H2O��
�ڼ���̼��п��������Һ�е������ӷ�Ӧ���������Һ��pH��ʹ��Һ�е�Fe3+ת��Ϊ��������������ȥ��ͬʱ���������ʡ�������Һ����c(Fe3+)Ϊ2.6��10-18mol/L����ΪKsp[Fe(OH)3]=2.6��10-39������c(OH-)=![]() mol/L������2���õ�������п��KSP=1.0��10-17������c(Zn2+)=1.0��10-17��(1.0��10-7)2=1.0��10-3��
mol/L������2���õ�������п��KSP=1.0��10-17������c(Zn2+)=1.0��10-17��(1.0��10-7)2=1.0��10-3��


 �Ƹ������������ϵ�д�
�Ƹ������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij������Ʒ�к��������Ȼ���������������ͼ��ʾװ�����ⶨ������Ʒ��̼���Ƶ���������(����̨�����е���ͼ�о�����ȥ)��ʵ�鲽�����£�

�ٰ�ͼ����װ�ã�����������ԣ�
��ȷ�Ƶ�ʢ�м�ʯ��(�����������ƺ���ʯ�ҵĻ����)�ĸ���� D ������Ϊ 86.4g��
��ȷ�Ƶ� 6g ������Ʒ�������� b �У�
�ܴ�Һ©�� a ����������������ϡ���ᣬ�����ٲ�������Ϊֹ��
�ݴ��ɼУ����Թ� A �л���������������ӣ�Ȼ��Ƶø���� D ��������Ϊ 88.6g�� �Իش�
(1)���������Ŀ����_____��װ�� A ���Լ� X Ӧѡ��_____��
(2)��������������ʵ�����̫�죬��ᵼ�²ⶨ���_____(����ƫ��������ƫС��)
(3)��û�� C װ�ã���ᵼ�²ⶨ���_____(����ƫ��������ƫС��)
(4)����ʵ���в�õ��й����ݣ������������Ʒ Na2CO3 ����������Ϊ_____��
(5)��ʵ������Ƿ��������_____(����������������)�������ڣ��Ľ���ʩΪ_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������в����������ֽ���ǣ�������
A.NaHCO3
B.AgBr
C.AgCl
D.HClO
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1) ��ͼ��ʾΪ��άƽ�澧��ʾ��ͼ,����ʾ�Ļ�ѧʽΪAX3����____��
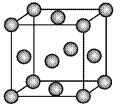
(2)ͼΪһ������ͭ�ľ���,��������¸��⡣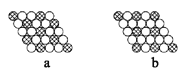
�ٸþ�����ʵ�ʡ�ӵ�е�ͭԭ������____����
�ڸþ�����Ϊ____��(�����)
A.�������� B.������������ C.������������
�۴˾���������ı߳�Ϊa cm,Cu�����ԭ������Ϊ64,����ͭ���ܶ�Ϊ�� g��cm-3,���ӵ�����Ϊ________________________(��a���ѱ�ʾ���г�����ʽ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ʊ�ͭ��(YBa2Cu3O7-x)����³�������(����Y��+3�ۣ�Cu��+2��+3��)����Y2(CO3)3��BaCO3��CuCO3����ڸ����·�Ӧ�Ƶá��ش��������⣺
(1)Y(��)��һ��ϡ������Ԫ�أ���Sc(��)ͬ�����ڡ�X��Ԫ�����ڱ��е�λ����_______��Ŀǰ�����ڱ��У����干��______��Ԫ�ء�
(2)��̬Cu3+�ĵ����Ų�ʽΪ________��ͭ��CuO��Cu2O������������߱�ǰ�����ȶ���ǿ��ԭ����____________________________________��
(3) CO32-��Cԭ���ȡ_______�ӻ�����һ�����ܣ�C_____O(����>������<��)��
(4)ij���Ʊ�ͭ��������x=0.2����n(Cu3+):n(Cu2+)=________��
(5)��ͼ����һ���Ʊ�ͭ���������ϵľ����ṹʾ��ͼ���仯ѧʽΪ______��������Y3+��������______������Ħ������ΪMg��mol-1�������ӏ�������ֵΪNA����þ�����ܶ�Ϊ____g��cm-3��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�Na2CO3��NaHCO3������˵����ȷ����
A. �ܽ����Na2CO3��NaHCO3
B. ��ͼ��ʾװ�ÿ�֤���ȶ�����Na2CO3��NaHCO3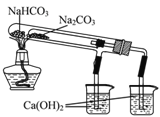
C. �ó���ʯ��ˮ�ɼ���Na2CO3��Һ��NaHCO3��Һ
D. ��������Na2CO3��NaHCO3�ֱ���������ᷴӦ����CO2������ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������W��X��Y��Z�ķ���ʽ��ΪC8H10�� Z�Ŀռ�ṹ���������ӡ�����˵����ȷ����

A. ������W��ͬ���칹��ֻ��X��Y��Z
B. W��X��Y��Z����ʹ����KMnO4��Һ��ɫ����2��
C. W��Z��һ�ȴ�������Ŀ���ٵ�Z
D. 1molX��1molY ������Br2/CCl4��Һ��Ӧ�������Br2��Ϊ2mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������NH3��BF3����ͨ����λ���γ�NH3��BF3��
(1)������������_________________________________��
(2)��NH3��BF3�У�________ԭ���ṩ�¶Ե��ӣ�________ԭ�ӽ��ܵ��ӡ�
(3)д��NH3��BF3�ĵ���ʽ���á����������λ����______________________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼ��ʾ��ת����ϵ���ҵ�X��Y��Z�����ʵ������ʱ�������ʱ���H=��H1+��H2����������������X��Y������

��C��CO ��S��SO2 ��Na��Na2O ��AlCl3��Al(OH)3 ��Fe��Fe(NO3)2 ��NaOH��Na2CO3
A. �٢ܢ� B. �٢ڢ� C. �٢ۢ� D. �٢ۢܢݢ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com