
【题目】如图所示是过氧化氢(H2O2)分子的空间结构示意图。
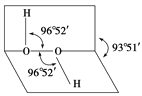
(1)写出过氧化氢分子的电子式________。
(2)下列关于过氧化氢的说法中正确的是(填序号)____。
①分子中有极性键 ②分子中有非极性键 ③氧原子的轨道发生了sp2杂化 ④O—O共价键是p—pσ键 ⑤分子是非极性分子
(3)过氧化氢分子之间易形成氢键,该氢键的表示式是____________。
(4)过氧化氢难溶于二硫化碳,主要原因是______________________;过氧化氢易溶于水,主要原因是________________________。
(5)过氧乙酸也是一种过氧化物,它可以看作是过氧化氢分子中的一个氢原子被乙酰基(CH3CO)取代的产物,是一种常用的杀菌消毒剂。在酸性条件下过氧乙酸易发生水解反应生成过氧化氢。
①写出过氧乙酸发生水解反应的化学方程式(有机物用结构简式表示):____________。
②过氧乙酸用作杀菌消毒剂的原因是________________________________________。
【答案】 ![]() ①② O-H…O H2O2是极性分子,CS2是非极性分子,依据相似相溶的原理可知,H2O2难溶于CS2 H2O2中氧元素的电负性很强,H2O2分子H2O分子之间形成氢键,使H2O2与水任意比互溶
①② O-H…O H2O2是极性分子,CS2是非极性分子,依据相似相溶的原理可知,H2O2难溶于CS2 H2O2中氧元素的电负性很强,H2O2分子H2O分子之间形成氢键,使H2O2与水任意比互溶  +H2O→CH3COOH+H2O2 过氧乙酸分子中有O-O键,有强氧化性
+H2O→CH3COOH+H2O2 过氧乙酸分子中有O-O键,有强氧化性
【解析】(1)过氧化氢的电子式为![]() ;(2)①H-O为极性键,故①正确;②O-O为非极性键,故②正确;③由H2O2的结构可知,O原子形成1个O-H键、1个O-O键,含有2对孤对电子,杂化轨道数为4,杂化方式为sp3,故③错误;④O的s轨道电子和O的s轨道电子成键,故是s-sσ键,故④错误;⑤过氧化氢中的键的极性不能相互抵消,是极性分子,⑤错误;答案选①②;(3)O元素的电负性很强,O原子与H原子之间可以形成氢键,该氢键的表示式为O-H…O;(4)H2O2是极性分子,CS2是非极性分子,依据相似相溶的原理可知,H2O2难溶于CS2;H2O2中氧元素的电负性很强,H2O2分子H2O分子之间形成氢键,使H2O2与水任意比互溶;(5)①过氧乙酸发生水解反应的化学方程式为:
;(2)①H-O为极性键,故①正确;②O-O为非极性键,故②正确;③由H2O2的结构可知,O原子形成1个O-H键、1个O-O键,含有2对孤对电子,杂化轨道数为4,杂化方式为sp3,故③错误;④O的s轨道电子和O的s轨道电子成键,故是s-sσ键,故④错误;⑤过氧化氢中的键的极性不能相互抵消,是极性分子,⑤错误;答案选①②;(3)O元素的电负性很强,O原子与H原子之间可以形成氢键,该氢键的表示式为O-H…O;(4)H2O2是极性分子,CS2是非极性分子,依据相似相溶的原理可知,H2O2难溶于CS2;H2O2中氧元素的电负性很强,H2O2分子H2O分子之间形成氢键,使H2O2与水任意比互溶;(5)①过氧乙酸发生水解反应的化学方程式为: +H2O→CH3COOH+H2O2;②过氧乙酸用作杀菌消毒剂的原因是过氧乙酸分子中有O-O键,有强氧化性。
+H2O→CH3COOH+H2O2;②过氧乙酸用作杀菌消毒剂的原因是过氧乙酸分子中有O-O键,有强氧化性。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在某无色、透明的强酸性溶液中,能大量共存的离子组是( )
A.NH4+、NO3-、Al3+、Cl-B.Na+、SO42-、Ba2+、NO3-
C.MnO4-、K+、SO42-、Na+D.H+、SO42-、HCO3-、Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无机化合物可根据其组成和性质进行分类。

(1)上图所示的物质分类方法名称是________。
(2)以Na、K、H、O、C、S、N中任两种或三种元素组成合适的物质,分别填在下表中。
___________、______________、_______________
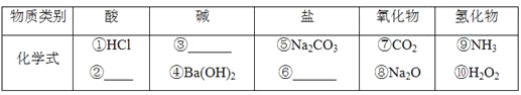
(3)写出⑦转化为⑤的化学方程式:__________________________________________。
(4)实验室制备⑦常用________和________反应,检验该气体的方法是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物D和J的合成路线如下(部分反应条件和产物己经略去):

回答下列问题:
(1)E的结构简式为_______,F的名称为_____,B中含氧官能团的名称为__________。
(2)G→I的化学方程式为_________________,丙烯→A的反应类型为______________。
(3)B的同分异构体中,分子中苯环上有5个取代基且能发生银镜反应的共有____种,其中核磁共振氢谱有5组峰,且峰面积比为1:1:2:6:6的是______(填结构简式)。
(4)结合上述流程中的信息,写出以 和CH3COOH为原料(无机试剂任选),制备化合物
和CH3COOH为原料(无机试剂任选),制备化合物 的合成路线:______________________。
的合成路线:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】判断含氧酸酸性强弱的一条经验规律是:含氧酸分子结构中含非羟基氧原子数越多,该含氧酸的酸性越强。如下表所示:
含氧酸酸性强弱与非羟基氧原子数的关系
次氯酸 | 磷酸 | 硫酸 | 高氯酸 | |
含氧酸 | Cl—OH |
|
|
|
非羟基氧原子数 | 0 | 1 | 2 | 3 |
酸性 | 弱酸 | 中强酸 | 强酸 | 最强酸 |
(1)亚磷酸H3PO3和亚砷酸H3AsO3分子式相似,但它们的酸性强弱相差很大,H3PO3是中强酸,H3AsO3既有弱酸性又有弱碱性。由此可知它们的结构式分别为①__________,②__________。
(2)H3PO3和H3AsO3与过量的NaOH溶液反应的化学方程式分别是①__________,②__________。
(3)在H3PO3和H3AsO3中分别加入浓盐酸,分析反应情况__________,写出反应的化学方程式________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是 ( )
A. 冰融化时,分子中H—O键发生断裂
B. 原子晶体中,共价键的键长越短,通常熔点就越高
C. 分子晶体中,共价键键能越大,该分子的熔沸点就越高
D. 分子晶体中,分子间作用力越大,则分子越稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液只含有Na+、 Fe3+、Cl-、SO42-4种离子,已知溶液中Na+、Fe3+、Cl-的个数之比为3:2:1。则溶液中Fe3+和SO42-的个数之比为:
A.3:4B.1:4C.1:2D.3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁红(主要成分为Fe2O3)是一种用途广泛的颜料,用废铁屑制备铁红的流程如下:

(1)操作Ⅰ的名称是_________。
(2)检验FeCO3沉淀是否洗净的实验方法是________。
(3)加入NH4HCO3溶液的反应除了生成FeCO3沉淀,还会生成一种气体,生成气体的离子方程式为________。
(4)在空气中煅烧FeCO3的化学方程式是________,若煅烧不充分,产品Fe2O3中会有FeO,为了避免产品中有FeO,可以采取的措施是________。
(5)称取3.0 g 产品,用稀硫酸溶解,逐滴加入0.10 mol·L-1 KMnO4溶液20.00 mL,二者恰好反应完全。若此产品中只含有FeO、Fe2O3,求算产品中Fe2O3的质量分数,写出计算过程___。
(已知:10FeSO4+2KMnO4+8H2SO4===5Fe2(SO4)3+2MnSO4+K2SO4+8H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的金属Na、Mg、Al分别与100mL2mol/L盐酸反应,实验测得生成气体的体积V(已折合为标准状况)与时间t的关系如图所示,则下列说法不正确的是( )

A. x=2.24
B. 反应时,Na、Mg、Al均过量
C. 钠的物质的量为0.2 mol
D. 曲线b为Mg与盐酸反应的图像
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com