
【题目】将等物质的量的金属Na、Mg、Al分别与100mL2mol/L盐酸反应,实验测得生成气体的体积V(已折合为标准状况)与时间t的关系如图所示,则下列说法不正确的是( )

A. x=2.24
B. 反应时,Na、Mg、Al均过量
C. 钠的物质的量为0.2 mol
D. 曲线b为Mg与盐酸反应的图像
【答案】B
【解析】
由于最后生成的气体量相同,所以这些金属置换出的氢气量相等,即等物质的量的三种金属失去了相同数量的电子,而若盐酸过量的话,这些金属失去的电子数因该是不一样的,比值应是1:2:3,故推断出盐酸不可能过量,但可能刚好和Na反应完全,此时Na完全反应而Mg、Al还有剩余,由此分析。
A、由于酸不足,所以生成氢气的量为n(H2)=0.5n(HCl)=0.5×0.1L×2mol/L=0.1mol,所以标况下的体积为2.24L,故A正确;
B、Na不可能过量,即使过量也要与溶剂水反应,故B错误;
C、生成0.1mol的氢气需0.2mol的钠,故C正确;
D、按照金属活动性顺序Na>Mg>Al可知钠和盐酸反应最激烈,产生相同的氢气需要的时间最少,故中间那条线是Mg与盐酸反应的图像,故D正确;
答案选B。


科目:高中化学 来源: 题型:
【题目】如图所示是过氧化氢(H2O2)分子的空间结构示意图。
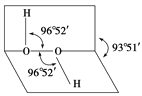
(1)写出过氧化氢分子的电子式________。
(2)下列关于过氧化氢的说法中正确的是(填序号)____。
①分子中有极性键 ②分子中有非极性键 ③氧原子的轨道发生了sp2杂化 ④O—O共价键是p—pσ键 ⑤分子是非极性分子
(3)过氧化氢分子之间易形成氢键,该氢键的表示式是____________。
(4)过氧化氢难溶于二硫化碳,主要原因是______________________;过氧化氢易溶于水,主要原因是________________________。
(5)过氧乙酸也是一种过氧化物,它可以看作是过氧化氢分子中的一个氢原子被乙酰基(CH3CO)取代的产物,是一种常用的杀菌消毒剂。在酸性条件下过氧乙酸易发生水解反应生成过氧化氢。
①写出过氧乙酸发生水解反应的化学方程式(有机物用结构简式表示):____________。
②过氧乙酸用作杀菌消毒剂的原因是________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知液氨的性质与水相似。T℃时,NH3+NH3![]() NH4++NH2-,NH4+的平衡浓度为1×10-15mol/L,则下列说法中正确的是( )
NH4++NH2-,NH4+的平衡浓度为1×10-15mol/L,则下列说法中正确的是( )
A. 在此温度下液氨的离子积为1×10-17
B. 在液氨中放入金属钠,可生成NaNH2
C. 恒温下,在液氨中加入NH4Cl,可使液氨的离子积减小
D. 降温,可使液氨电离平衡逆向移动,且c(NH4+)<c(NH2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示。则下列离子组在对应的溶液中一定能大量共存的是
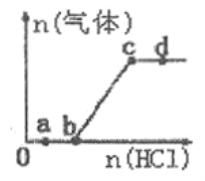
A. a点对应的溶液中:Na+、Ca2+、SO42-、NO3-
B. b点对应的溶液中:K+、Na+、OH-、Cl-
C. c点对应的溶液中: Na+、Ca2+、NO3-、Cl-
D. d点对应的溶液中: Cl-、NO3-、Fe2+、Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,有关物质的电离平衡常数如下:
化学式 | CH3COOH | H2CO3 | H2SO3 |
电离平衡常数 | K=1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=1.5×10-2 K2=1.02×10-7 |
(1)请写出H2SO3的电离平衡常数K1的表达式:________________。
(2) 常温下,将体积为10mL pH=2的醋酸溶液与亚硫酸溶液分别加蒸馏水稀释至1000mL,稀释后溶液的pH,前者_____后者(填“>”、“<”或“=”)。
(3)一定条件下,冰醋酸加水稀释过程中溶液导电能力I随加水体积V变化曲线如右图所示,则a、b、c三点溶液醋酸的电离程度由大到小为____________________。

(4)下列离子CH3COO-、CO32-、HSO3-、SO32-在溶液中结合H+的能力由大到小的关系为___________。
(5)体积相同、c(H+)相同的①CH3COOH;②HCl;③H2SO4 三种酸溶液分别与同浓度的NaOH溶液完全中和时,消耗NaOH溶液的体积由大到小的排列顺序是_____(填序号)。
(6)已知,H+(aq) + OH-(aq) == H2O(l) ΔH =-57.3 kJ/mol。实验测得稀醋酸与稀NaOH溶液反应生成1 mol H2O时放出57 kJ的热,则醋酸溶液中,醋酸电离的热化学方程式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物N是制备某药品的中间体,其合成路线如下(部分产物和条件已略):

已知:RCN![]() RCOOH
RCOOH![]() RCOCl
RCOCl![]() RCOOR'
RCOOR'
请按要求回答下列问题:
(1)已知A标准状况下的密度为1.25g/L,则A的结构简式为_______;其分子共平面的原子数目为____________。
(2)B的官能团名称为________。反应①的反应类型为_______。F的名称为_______ 。
(3)P是比A相对分子质量大28的同系物,P的所有可能的结构(含p)数目为______。写出P的属于环烃的同分异构体的结构简式: ______ 。
(4)写出反应②的化学方程式: ______。
(5)已知:  。參照上述流程,设计以G为原料制备K的合成路线(无机试剂任选):_______________。
。參照上述流程,设计以G为原料制备K的合成路线(无机试剂任选):_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)147 g H2SO4的物质的量是________;0.5 mol H2SO4的质量是________g;
(2)氧化铜在高温下发生分解反应:4CuO![]() 2Cu2O+O2↑,若反应过程中生成1molO2分子,则转移电子数为____________mol。
2Cu2O+O2↑,若反应过程中生成1molO2分子,则转移电子数为____________mol。
(3)反应:2FeCl3+2KI=2FeCl2+2KCl+I2,其中_____元素化合价升高,则该元素被_______,_____元素化合价降低;__________做还原剂,_______发生还原反应。
(4)钠在空气中燃烧的化学方程式:________________________________,1mol钠完全燃烧转移电子的个数为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】掌握仪器名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置。
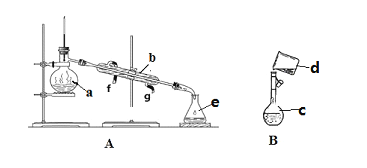
(1)写出下列仪器的名称:a.____________,b.___________,c.__________。
(2)若利用装置分离酒精和水的混合物,还缺少的仪器是______,冷凝水由___口流出(填f或g)。
(3)现需配制0.1mol/LNaOH溶液450mL,装置B是某同学转移溶液的示意图。
①图中的错误是_____________________________。
②根据计算得知,所需NaOH的质量为____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com