
【题目】(1)147 g H2SO4的物质的量是________;0.5 mol H2SO4的质量是________g;
(2)氧化铜在高温下发生分解反应:4CuO![]() 2Cu2O+O2↑,若反应过程中生成1molO2分子,则转移电子数为____________mol。
2Cu2O+O2↑,若反应过程中生成1molO2分子,则转移电子数为____________mol。
(3)反应:2FeCl3+2KI=2FeCl2+2KCl+I2,其中_____元素化合价升高,则该元素被_______,_____元素化合价降低;__________做还原剂,_______发生还原反应。
(4)钠在空气中燃烧的化学方程式:________________________________,1mol钠完全燃烧转移电子的个数为____________。
【答案】1.5mol 49 4 碘(或I) 氧化 铁(或Fe) KI FeCl3 2Na + O2 ![]() Na2O2 NA
Na2O2 NA
【解析】
(1)根据n=![]() 分析解答;
分析解答;
(2)反应中氧元素的化合价由-2价升高为0价,据此分析计算;
(3)反应2FeCl3+2KI═2FeCl2+2KCl+I2中,I元素化合价升高,Fe元素化合价降低,结合氧化还原反应的规律分析解答;
(4)钠在空气中燃烧生成过氧化钠,据此书写反应的化学方程式,反应后钠的化合价为+1价,据此判断转移的电子数。
(1)n(H2SO4)=![]() =1.5mol;0.5mol H2SO4的质量是0.5mol×98g/mol=49g,故答案为:1.5mol;49;
=1.5mol;0.5mol H2SO4的质量是0.5mol×98g/mol=49g,故答案为:1.5mol;49;
(2)反应中O元素的化合价部分由-2价升高到0价,生成一个氧气分子转移的电子数为4,则生成1molO2分子,则转移电子数为4mol,故答案为:4;
(3)反应2FeCl3+2KI═2FeCl2+2KCl+I2中,I元素化合价升高,失电子被氧化,KI为还原剂,Fe元素化合价降低,得电子被还原,铁元素得电子,化合价降低,所以FeCl3氧化剂,被还原,故答案为:I;氧化;Fe;碘化钾;氯化铁;
(4)钠在空气中燃烧生成过氧化钠,反应的化学方程式为2Na + O2 ![]() Na2O2,反应后钠的化合价为+1价,1mol钠完全燃烧转移1mol电子,个数为NA,故答案为:2Na + O2
Na2O2,反应后钠的化合价为+1价,1mol钠完全燃烧转移1mol电子,个数为NA,故答案为:2Na + O2 ![]() Na2O2;NA。
Na2O2;NA。


科目:高中化学 来源: 题型:
【题目】铁红(主要成分为Fe2O3)是一种用途广泛的颜料,用废铁屑制备铁红的流程如下:

(1)操作Ⅰ的名称是_________。
(2)检验FeCO3沉淀是否洗净的实验方法是________。
(3)加入NH4HCO3溶液的反应除了生成FeCO3沉淀,还会生成一种气体,生成气体的离子方程式为________。
(4)在空气中煅烧FeCO3的化学方程式是________,若煅烧不充分,产品Fe2O3中会有FeO,为了避免产品中有FeO,可以采取的措施是________。
(5)称取3.0 g 产品,用稀硫酸溶解,逐滴加入0.10 mol·L-1 KMnO4溶液20.00 mL,二者恰好反应完全。若此产品中只含有FeO、Fe2O3,求算产品中Fe2O3的质量分数,写出计算过程___。
(已知:10FeSO4+2KMnO4+8H2SO4===5Fe2(SO4)3+2MnSO4+K2SO4+8H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的金属Na、Mg、Al分别与100mL2mol/L盐酸反应,实验测得生成气体的体积V(已折合为标准状况)与时间t的关系如图所示,则下列说法不正确的是( )

A. x=2.24
B. 反应时,Na、Mg、Al均过量
C. 钠的物质的量为0.2 mol
D. 曲线b为Mg与盐酸反应的图像
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列有关叙述正确的是
A. 标准状况下,向2.24L密闭容器中充满NO2气体,其所含分子数为0.1 NA
B. CuO和Cu2S的混合物80 g中,所含铜粒子数为2NA
C. 常温常压下,22gT2O含中子数为12NA
D. 1.0 L 1.0 mol·L-1的NaNO3水溶液中含有的氧原子数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度和压强下的理想气体,影响其所占体积大小的主要因素是( )
A.分子直径的大小
B.分子间距离的大小
C.分子间引力的大小
D.分子数目的多少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由于镁合金具有硬度大、密度小、散热性好、抗震性好等优异性能它被用于制笔记本电脑外壳、竞赛自行车车架等。现称取一定质量的镁铝合金样品放入500 mL稀硫酸中,固体全部溶解并放出气体。待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如下图所示。

(1)合金中Al的质量为__________________。
(2)NaOH溶液的物质的量浓度为__________________。
(3)稀硫酸的物质的量浓度为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A.萃取操作可在普通漏斗中完成
B.浓烧碱液沾到皮肤上应立即用稀盐酸冲洗
C.闻未知液体或气体的气味时,应该将试剂瓶口距离口鼻远一些,用手轻轻扇动
D.用容量瓶配制好一定浓度的某溶液后,将溶液保存在容量瓶中并贴上标签
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化苄(C6H5CH2Cl)为无色液体,是一种重要的有机化工原料。现在实验室模拟工业上用甲苯与干燥氯气在光照条件下加热反应合成氯化苄、分离出氯化苄并检验样品的纯度,其装置(夹持装置略去)如图所示:
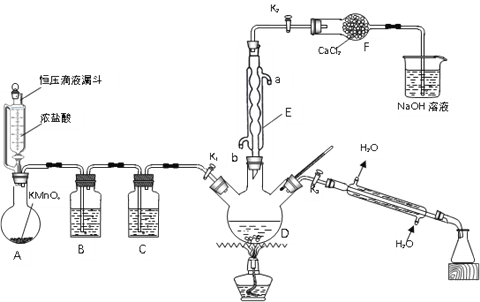
回答下列问题:
(1)仪器E的名称是______;其作用是______;其进水口为______(填“a”或“b”)。
(2)装置B中的溶液为______;装置F的作用是______。
(3)用恒压滴液漏斗代替分液漏斗的优点是______。
(4)装置A中反应的离子方程式为______。
(5)反应结束后,关闭K1和K2,打开K3,加热三颈烧瓶,分馏出氯化苄,应选择温度范围为______℃。
物质 | 溶解性 | 熔点(℃) | 沸点(℃) |
甲苯 | 极微溶于水,能与乙醇、乙醚等混溶 | -94.9 | 110 |
氯化苄 | 微溶于水,易溶于苯、甲苯等有机溶剂 | -39 | 178.8 |
二氯化苄 | 不溶于水,溶于乙醇、乙醚 | -16 | 205 |
三氯化苄 | 不溶于水,溶于乙醇、乙醚和苯 | -7 | 220 |
(6)检测氯化苄样品的纯度:
①称取13.00g样品于烧杯中,加入50.00mL 4 molL-1 NaOH水溶液,水浴加热1小时,冷却后加入35.00mL 40% HNO3,再将全部溶液转移到容量瓶中配成100mL溶液。取20.00mL溶液于试管中,加入足量的AgNO3溶液,充分振荡,过滤、洗涤、干燥,称量固体质量为2.87g,则该样品的纯度为______%(结果保留小数点后1位)。
②实际测量结果可能偏高,原因是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以Ni的氧化物作催化剂,将丙烯氨氧化制得丙烯腈(CH2=CHCN),然后以H3PO4-K3PO4等作为电解质溶液,电解丙烯腈制已二腈。已知总反应的化学方程式为:4CH2=CHCN+2H2O![]() O2↑+2NC(CH2)4CN。
O2↑+2NC(CH2)4CN。
(1)基态Ni原子价层电子的轨道表达式为_______;在上述总反应的化学方程式中所涉及到的各元素中,电负性由小到大的顺序为_______。
(2)PO43-的空间构型是_______,CH2=CHCN中碳原子的杂化方式为_______ 。
(3)NC(CH2)4CN分子中σ键与π键数目之比为_______。
(4)已知K3PO4是离子晶体,写出其主要物理性质_____(写出2条即可)。
(5)反应中核心元素碳有金刚石、石墨等多种同素异形体。设石墨晶体中碳碳键的键长为am,金刚石晶体中碳碳键的键长为bm,则a____b(填“>”、“=”或“<”),原因________。
(6)金刚石的晶胞结构如下图1所示,已知ZnS晶胞与金刚石晶胞微粒排列方式相同,若图中a为Zn2+,则S2-处于ZnS晶胞中的位置为_________。

(7)石墨烯中部分碳原子被氧化后,转化为氧化石墨烯(如图2所示)
①石墨烯转化为氧化石墨烯时,1号C与相邻C原子间键能的变化是___(填“变大”、“变小”“不变”)。
②石墨烯具有很大的比表面积,可用于制超级电容器。若石墨烯中碳碳键的键长为am,12g单层石墨烯的单面理论面积约为_______m3(列出计算式即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com