
【题目】工业上以Ni的氧化物作催化剂,将丙烯氨氧化制得丙烯腈(CH2=CHCN),然后以H3PO4-K3PO4等作为电解质溶液,电解丙烯腈制已二腈。已知总反应的化学方程式为:4CH2=CHCN+2H2O![]() O2↑+2NC(CH2)4CN。
O2↑+2NC(CH2)4CN。
(1)基态Ni原子价层电子的轨道表达式为_______;在上述总反应的化学方程式中所涉及到的各元素中,电负性由小到大的顺序为_______。
(2)PO43-的空间构型是_______,CH2=CHCN中碳原子的杂化方式为_______ 。
(3)NC(CH2)4CN分子中σ键与π键数目之比为_______。
(4)已知K3PO4是离子晶体,写出其主要物理性质_____(写出2条即可)。
(5)反应中核心元素碳有金刚石、石墨等多种同素异形体。设石墨晶体中碳碳键的键长为am,金刚石晶体中碳碳键的键长为bm,则a____b(填“>”、“=”或“<”),原因________。
(6)金刚石的晶胞结构如下图1所示,已知ZnS晶胞与金刚石晶胞微粒排列方式相同,若图中a为Zn2+,则S2-处于ZnS晶胞中的位置为_________。

(7)石墨烯中部分碳原子被氧化后,转化为氧化石墨烯(如图2所示)
①石墨烯转化为氧化石墨烯时,1号C与相邻C原子间键能的变化是___(填“变大”、“变小”“不变”)。
②石墨烯具有很大的比表面积,可用于制超级电容器。若石墨烯中碳碳键的键长为am,12g单层石墨烯的单面理论面积约为_______m3(列出计算式即可)。
【答案】 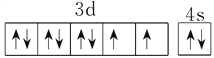 H<C<N<O 正四面体 sp、sp2 15:4 熔融时能导电、熔点较高、硬度较大 < 石墨晶体中碳碳键除σ键外还有大π键,金刚石晶体中碳碳键只有σ键 顶点、面心 变小
H<C<N<O 正四面体 sp、sp2 15:4 熔融时能导电、熔点较高、硬度较大 < 石墨晶体中碳碳键除σ键外还有大π键,金刚石晶体中碳碳键只有σ键 顶点、面心 变小 ![]()
【解析】分析:(1)根据核外电子排布规律书写轨道表达式;非金属性越强,电负性越大;
(2)根据价层电子对互斥理论解答;
(3)根据分子中含有的共价键判断;
(4)根据离子晶体的性质特点解答;
(5)根据石墨和金刚石中含有的化学键分析;
(6)根据金刚石的晶胞结构并依据硫化锌的化学式判断;
(7)石墨烯转化为氧化石墨烯时,1号C 连接的O原子吸引电子能力较强,导致与1号C原子相邻C原子对电子的吸引力减小;根据晶胞结构依据均摊法计算。
详解:(1)Ni的原子序数是28,其基态Ni原子价层电子的轨道表达式为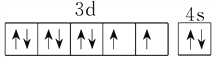 ;非金属性越强,电负性越大,则在上述总反应的化学方程式中所涉及到的各元素中,电负性由小到大的顺序为H<C<N<O。
;非金属性越强,电负性越大,则在上述总反应的化学方程式中所涉及到的各元素中,电负性由小到大的顺序为H<C<N<O。
(2)PO43-的价层电子对数是4,不存在孤对电子,空间构型是正四面体;CH2=CHCN中形成碳碳双键的碳原子是sp2杂化,又因为C与N之间是三键,则该碳原子的杂化方式为sp杂化。
(3)NC(CH2)4CN分子中除C与N之间是三键以外,其余均是单键。由于单键均是σ键,三键中含有1个σ键和2个π键,则σ键与π键数目之比为15:4。
(4)已知K3PO4是离子晶体,其主要物理性质有熔融时能导电、熔点较高、硬度较大等。
(5)由于石墨晶体中碳碳键除σ键外还有大π键,金刚石晶体中碳碳键只有σ键,所以a<b。
(6)已知ZnS晶胞与金刚石晶胞微粒排列方式相同,若图中a为Zn2+,这说明锌全部位于晶胞中,共计是4个,根据化学式ZnS可知S2-处于ZnS晶胞中的位置为顶点、面心。
(7)①石墨烯转化为氧化石墨烯时,1号C 连接的O原子吸引电子能力较强,导致与1号C原子相邻C原子对电子的吸引力减小,所以1号C 与相邻C原子间键能的变化是变小;
②单层石墨烯中含有C原子个数=6×1/3=2,每个六边形面积=![]() 。12g单层石墨烯中原子个数为NA,因此12g单层石墨烯的单面理论面积
。12g单层石墨烯中原子个数为NA,因此12g单层石墨烯的单面理论面积![]() 。
。


科目:高中化学 来源: 题型:
【题目】(1)147 g H2SO4的物质的量是________;0.5 mol H2SO4的质量是________g;
(2)氧化铜在高温下发生分解反应:4CuO![]() 2Cu2O+O2↑,若反应过程中生成1molO2分子,则转移电子数为____________mol。
2Cu2O+O2↑,若反应过程中生成1molO2分子,则转移电子数为____________mol。
(3)反应:2FeCl3+2KI=2FeCl2+2KCl+I2,其中_____元素化合价升高,则该元素被_______,_____元素化合价降低;__________做还原剂,_______发生还原反应。
(4)钠在空气中燃烧的化学方程式:________________________________,1mol钠完全燃烧转移电子的个数为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】掌握仪器名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置。
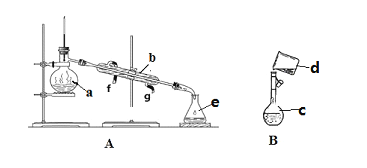
(1)写出下列仪器的名称:a.____________,b.___________,c.__________。
(2)若利用装置分离酒精和水的混合物,还缺少的仪器是______,冷凝水由___口流出(填f或g)。
(3)现需配制0.1mol/LNaOH溶液450mL,装置B是某同学转移溶液的示意图。
①图中的错误是_____________________________。
②根据计算得知,所需NaOH的质量为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,用0.1000mol/LNaOH滴定25.00 mL 0.1000 mol/L某一元酸HX,滴定过程中pH变化曲线如图所示。下列说法正确的是 ( )

A. 滴定前,酸中c(H+)等于碱中c(OH-)
B. 在A点,c(Na+)>c(X-)>c(HX)>c(H+)>c(OH-)
C. 在B点,两者恰好完全反应
D. 在C点,c(X-)+c(HX)=0.05mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知温度T时水的离子积常数为Kw,该温度下,将浓度为amol/L的一元酸HA与bmol/L的一元碱BOH等体积混合,可判断该溶液呈中性的依据是:
A. a=b
B. 混合溶液的pH值为7
C. 混合溶液中C(H+)=![]()
D. 混合溶液中,c(H+)+c(B+)=c(OH-)+c(A-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】加热HCOONa固体,发生的反应有:2HCOONa ![]() Na2C2O4+H2↑ ①
Na2C2O4+H2↑ ①
2HCOONa ![]() Na2CO3 +H2↑+CO↑ ②
Na2CO3 +H2↑+CO↑ ②
Na2C2O4 ![]() Na2CO3 + CO ↑ ③
Na2CO3 + CO ↑ ③
HCOONa加热分解时,固体失重率与温度的关系如右图所示。下列说法正确的是( )

A. T<415℃时,只有反应①发生
B. 反应①、②不可能同时发生
C. 570℃<T<600℃时,残留固体的主要成分是Na2CO3
D. 残留固体中m(Na2C2O4)=m( Na2CO3)时,反应①、②的反应速率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将浓盐酸滴加到盛有二氧化锰粉末的圆底烧瓶中,实验室可用如图装置制取无水氯化铁(已知:FeCl3固体易吸收空气中的水发生潮解)。请回答下列问题:

(1)盛放浓盐酸的仪器名称为_______________。
(2)烧瓶中发生反应的化学方程式为__________________________________。
(3)C瓶中的试剂是________________。
(4)玻璃管D中发生反应的化学方程式为______________________________,反应现象是__________________________。
(5)干燥管E中盛有碱石灰,其作用是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.已知A、B、C、D四种分子所含原子的数目依次为 1、3、6、6,且都含有18个电子,B、C是由两种元素的原子组成,且分子中两种原子的个数比均为1∶2。D是一种有毒的有机物。
(1)组成A分子的原子的元素符号是 。
(2)从B分子的立体结构判断,该分子属于 (填“极性”或“非极性”)分子。
(3)C分子中包含 个σ键, 个π键。
(4)D的熔、沸点比C2H6的熔、沸点高,其主要原因是(需指明D是何物质): 。
Ⅱ.CO的结构可表示为![]() ,N2的结构可表示为
,N2的结构可表示为![]() 。
。
(5)下表是两者的键能数据:(单位:kJ·mol-1)
A—B |
|
| |
CO | 357.7 | 798.9 | 1 071.9 |
N2 | 154.8 | 418.4 | 941.7 |
结合数据说明CO比N2活泼的原因: 。
Ⅲ.Fe、Co、Ni、Cu等金属能形成配合物与这些金属原子的电子层结构有关。
(6)基态Ni原子的核外电子排布式为 ,基态Cu原子的外围电子排布式为 。
(7)Fe(CO)5常温下呈液态,熔点为-20.5 ℃,沸点为103 ℃,易溶于非极性溶剂,据此可判断Fe(CO)5晶体属于 (填晶体类型)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物有着广泛的用途。请回答:
(1)高炉炼铁是目前普遍采用的冶炼铁的方法。已知:
FeO(s)+CO(g)![]() Fe(s)+CO2(g) △H=a kJ·mol-1
Fe(s)+CO2(g) △H=a kJ·mol-1
Fe2O3(s)+CO(g)![]() 2FeO(s)+CO2 △H=b kJ·mol-1
2FeO(s)+CO2 △H=b kJ·mol-1
工业上用铁红冶炼铁的热化学方程式为_________________________________。
(2)Fe(NO3)3溶液可用于刻蚀银器,该过程中存在Fe2+和Fe3+之间的转化。
①该反应的离子方程式为_________________________________。
②T ℃时,向0.5mol·L-1 Fe(NO3)3溶液中加入足量Ag,溶液中c(Ag+)与反应时间(t)的关系如图1所示(溶液体积变化忽略不计)。
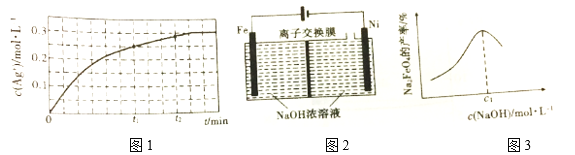
t1时,溶液中c(Fe3+)=__________;t1、t2时,逆反应速率v逆1______v逆2(填“>”“<”或“=”)理由为_________________________________。
③T ℃时,将体积均为100 mL的0.5mol·L-1 Fe(NO3)3溶液、0.4mol·L-1 Fe(NO3)2溶液、0.6mol·L-1 AgN03溶液混合后,再加入6.0g Ag,一段时间后,Ag的质量________(填“增大”“减小”或“不变”)。
④实验表明,相同条件下,FeCl3溶液比Fe(NO3)3溶液更容易刻蚀银,理由为__________。
(3)Na2FeO4是重要的水处理剂,在强碱性介质中稳定,可用图2所示装置制备。已知:电解时,碱的浓度过高,阳极区产生红色物质。
①电解时,阴极附近溶液的碱性__________(填“增大”“减小”或“不变”)。
②电解时,Na2FeO4的产率与起始加入的c(NaOH)的关系如图3所示。c(NaOH)=c1 mol·L-1时,Na2FeO4产率最大的原因为_________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com