
【题目】铁及其化合物有着广泛的用途。请回答:
(1)高炉炼铁是目前普遍采用的冶炼铁的方法。已知:
FeO(s)+CO(g)![]() Fe(s)+CO2(g) △H=a kJ·mol-1
Fe(s)+CO2(g) △H=a kJ·mol-1
Fe2O3(s)+CO(g)![]() 2FeO(s)+CO2 △H=b kJ·mol-1
2FeO(s)+CO2 △H=b kJ·mol-1
工业上用铁红冶炼铁的热化学方程式为_________________________________。
(2)Fe(NO3)3溶液可用于刻蚀银器,该过程中存在Fe2+和Fe3+之间的转化。
①该反应的离子方程式为_________________________________。
②T ℃时,向0.5mol·L-1 Fe(NO3)3溶液中加入足量Ag,溶液中c(Ag+)与反应时间(t)的关系如图1所示(溶液体积变化忽略不计)。
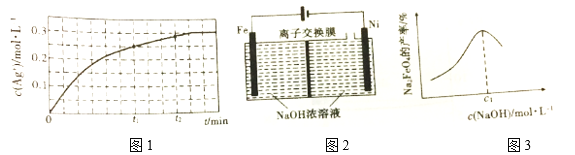
t1时,溶液中c(Fe3+)=__________;t1、t2时,逆反应速率v逆1______v逆2(填“>”“<”或“=”)理由为_________________________________。
③T ℃时,将体积均为100 mL的0.5mol·L-1 Fe(NO3)3溶液、0.4mol·L-1 Fe(NO3)2溶液、0.6mol·L-1 AgN03溶液混合后,再加入6.0g Ag,一段时间后,Ag的质量________(填“增大”“减小”或“不变”)。
④实验表明,相同条件下,FeCl3溶液比Fe(NO3)3溶液更容易刻蚀银,理由为__________。
(3)Na2FeO4是重要的水处理剂,在强碱性介质中稳定,可用图2所示装置制备。已知:电解时,碱的浓度过高,阳极区产生红色物质。
①电解时,阴极附近溶液的碱性__________(填“增大”“减小”或“不变”)。
②电解时,Na2FeO4的产率与起始加入的c(NaOH)的关系如图3所示。c(NaOH)=c1 mol·L-1时,Na2FeO4产率最大的原因为_________________________________。
【答案】 Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g) △H=(2a+b) kJ·mol-1 Fe3++Ag
2Fe(s)+3CO2(g) △H=(2a+b) kJ·mol-1 Fe3++Ag![]() Fe2++Ag+ 0.25mol·L-1 < t2时c(Ag+)更大,逆反应速率加快 减小 Ag+ 与Cl- 生成AgCl沉淀,c(Ag+)减小,Fe3++Ag
Fe2++Ag+ 0.25mol·L-1 < t2时c(Ag+)更大,逆反应速率加快 减小 Ag+ 与Cl- 生成AgCl沉淀,c(Ag+)减小,Fe3++Ag![]() Fe2++Ag+ 平衡正向移动 增大 c(NaOH)<c1 mol·L-1时,Na2FeO4稳定性差且反应慢;c(NaOH)>c1 mol·L-1时,有副反应发生
Fe2++Ag+ 平衡正向移动 增大 c(NaOH)<c1 mol·L-1时,Na2FeO4稳定性差且反应慢;c(NaOH)>c1 mol·L-1时,有副反应发生
【解析】(1)①FeO(s)+CO(g)![]() Fe(s)+CO2(g) △H=a kJ·mol-1,②Fe2O3(s)+CO(g)
Fe(s)+CO2(g) △H=a kJ·mol-1,②Fe2O3(s)+CO(g)![]() 2FeO(s)+CO2 △H=b kJ·mol-1,由盖斯定律,①×2+②,得工业上用铁红冶炼铁的热化学方程式为Fe2O3(s)+3CO(g)
2FeO(s)+CO2 △H=b kJ·mol-1,由盖斯定律,①×2+②,得工业上用铁红冶炼铁的热化学方程式为Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g) △H=(2a+b) kJ·mol-1 。(2)Fe(NO3)3溶液可用于刻蚀银器,该过程中存在Fe2+和Fe3+之间的转化,Fe3+将银氧化。①该反应的离子方程式为Fe3++Ag
2Fe(s)+3CO2(g) △H=(2a+b) kJ·mol-1 。(2)Fe(NO3)3溶液可用于刻蚀银器,该过程中存在Fe2+和Fe3+之间的转化,Fe3+将银氧化。①该反应的离子方程式为Fe3++Ag![]() Fe2++Ag+ 。②t1时,银离子浓度0.25mol·L-1 ,反应的铁离子为0.25mol·L-1 ,溶液中c(Fe3+)=0.25mol·L-1;t1、t2时,逆反应速率v逆1<v逆2,理由为t2时c(Ag+)更大,逆反应速率加快。③由②平衡时银离子浓度0.3mol·L-1 ,反应的铁离子为0.3mol·L-1 ,溶液中c(Fe3+)=0.2mol·L-1;平衡常数K=0.32/0.2=0.45,现T ℃时,将体积均为100 mL的0.5mol·L-1 Fe(NO3)3溶液、0.4mol·L-1 Fe(NO3)2溶液、0.6mol·L-1 AgN03溶液混合后,Qc=
Fe2++Ag+ 。②t1时,银离子浓度0.25mol·L-1 ,反应的铁离子为0.25mol·L-1 ,溶液中c(Fe3+)=0.25mol·L-1;t1、t2时,逆反应速率v逆1<v逆2,理由为t2时c(Ag+)更大,逆反应速率加快。③由②平衡时银离子浓度0.3mol·L-1 ,反应的铁离子为0.3mol·L-1 ,溶液中c(Fe3+)=0.2mol·L-1;平衡常数K=0.32/0.2=0.45,现T ℃时,将体积均为100 mL的0.5mol·L-1 Fe(NO3)3溶液、0.4mol·L-1 Fe(NO3)2溶液、0.6mol·L-1 AgN03溶液混合后,Qc=![]() =0.16<k,平衡正向移动,再加入6.0g Ag,一段时间后,Ag的质量减小。④实验表明,相同条件下,FeCl3溶液比Fe(NO3)3溶液更容易刻蚀银,因为溶液的组成不同,Ag+ 与Cl- 生成AgCl沉淀,c(Ag+)减小,Fe3++Ag
=0.16<k,平衡正向移动,再加入6.0g Ag,一段时间后,Ag的质量减小。④实验表明,相同条件下,FeCl3溶液比Fe(NO3)3溶液更容易刻蚀银,因为溶液的组成不同,Ag+ 与Cl- 生成AgCl沉淀,c(Ag+)减小,Fe3++Ag![]() Fe2++Ag+ 平衡正向移动。(3)①阳极是Fe失去电子,碱性条件下生成FeO42-,阳极电极反应式为:Fe-6e-+8OH-=FeO42-+4H2O,阴极:2H2O+2e-=2OH-+H2,阴极室得到A溶液为NaOH溶液,可以循环利用,电解时,阴极附近溶液的碱性增大。②电解时,Na2FeO4的产率与起始加入的c(NaOH)的关系如图3所示。c(NaOH)=c1 mol·L-1时,Na2FeO4产率最大的原因为:c(NaOH)<c1 mol·L-1时,Na2FeO4稳定性差且反应慢;c(NaOH)>c1 mol·L-1时,有副反应发生。
Fe2++Ag+ 平衡正向移动。(3)①阳极是Fe失去电子,碱性条件下生成FeO42-,阳极电极反应式为:Fe-6e-+8OH-=FeO42-+4H2O,阴极:2H2O+2e-=2OH-+H2,阴极室得到A溶液为NaOH溶液,可以循环利用,电解时,阴极附近溶液的碱性增大。②电解时,Na2FeO4的产率与起始加入的c(NaOH)的关系如图3所示。c(NaOH)=c1 mol·L-1时,Na2FeO4产率最大的原因为:c(NaOH)<c1 mol·L-1时,Na2FeO4稳定性差且反应慢;c(NaOH)>c1 mol·L-1时,有副反应发生。
点晴:难点(2)③判断反应进行的方向,用溶液的浓度商与K值进行比较,要通过读图求出K,易错点,求Qc,将体积均为100 mL的0.5mol·L-1 Fe(NO3)3溶液、0.4mol·L-1 Fe(NO3)2溶液、0.6mol·L-1 AgN03溶液混合后,Qc=![]() =0.16<K,计算式中的溶液的体积为原来的三分之一,易被忽略,0.6×0.4/0.5=0.45>k,导致错误。
=0.16<K,计算式中的溶液的体积为原来的三分之一,易被忽略,0.6×0.4/0.5=0.45>k,导致错误。


科目:高中化学 来源: 题型:
【题目】工业上以Ni的氧化物作催化剂,将丙烯氨氧化制得丙烯腈(CH2=CHCN),然后以H3PO4-K3PO4等作为电解质溶液,电解丙烯腈制已二腈。已知总反应的化学方程式为:4CH2=CHCN+2H2O![]() O2↑+2NC(CH2)4CN。
O2↑+2NC(CH2)4CN。
(1)基态Ni原子价层电子的轨道表达式为_______;在上述总反应的化学方程式中所涉及到的各元素中,电负性由小到大的顺序为_______。
(2)PO43-的空间构型是_______,CH2=CHCN中碳原子的杂化方式为_______ 。
(3)NC(CH2)4CN分子中σ键与π键数目之比为_______。
(4)已知K3PO4是离子晶体,写出其主要物理性质_____(写出2条即可)。
(5)反应中核心元素碳有金刚石、石墨等多种同素异形体。设石墨晶体中碳碳键的键长为am,金刚石晶体中碳碳键的键长为bm,则a____b(填“>”、“=”或“<”),原因________。
(6)金刚石的晶胞结构如下图1所示,已知ZnS晶胞与金刚石晶胞微粒排列方式相同,若图中a为Zn2+,则S2-处于ZnS晶胞中的位置为_________。

(7)石墨烯中部分碳原子被氧化后,转化为氧化石墨烯(如图2所示)
①石墨烯转化为氧化石墨烯时,1号C与相邻C原子间键能的变化是___(填“变大”、“变小”“不变”)。
②石墨烯具有很大的比表面积,可用于制超级电容器。若石墨烯中碳碳键的键长为am,12g单层石墨烯的单面理论面积约为_______m3(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如下图所示装置可以完成一系列实验(图中夹持装置已略去)

请回答下列问题:
Ⅰ. 若气体a是Cl2,装置A、B、C中的试剂依次为: FeCl2溶液、淀粉KI溶液、石蕊溶液。
(1)A溶液由浅绿色变为棕黄色,反应的离子方程式为_________________________________。
(2)B瓶中的淀粉KI溶液变为蓝色,反应的离子方程式为______________________________。
(3)C瓶中的现象为_______________________________________________________________。
(4)D装置中试剂为_______________________________________________________________。
II.若气体a是SO2,装置A、B、C中的试剂依次为:品红溶液、酸性高锰酸钾溶液、氢硫酸(硫化氢的水溶液)。
(1)A瓶中品红和B瓶中酸性高锰酸钾溶液均褪色,其中体现了SO2漂白性的是 _____(填写序号A或B)。
(2)C瓶中产生淡黄色沉淀, 反应的化学方程式_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E、F为周期表前四周期原子序数依次增大的六种元素。其中A是元素周期表中原子半径最小的元素,B原子最外层电子数是内层电子数的2倍。D、E为同主族元素,且E的原子序数为D的2倍。F元素在地壳中含量位于金属元素的第二位。试回答下列问题:
(1)F元素价层电子排布式为 _______________。
(2)关于B2A2的下列说法中正确的是 _________________。
A. B2A2中的所有原子都满足8电子结构
B. 每个B2A2分子中σ键和π键数目比为1:1
C. B2A2是由极性键和非极性键形成的非极性分子
D. B2A2分子中的B-A键属于s —spσ键
(3)B和D形成的一种三原子分子与C和D形成的一种化合物互为等电子体,则满足上述条件的B和D形成的化合物的空间构型是 ___________________。
(4)C元素原子的第一电离能比B、D两元素原子的第一电离能高的主要原因 _____________________________。
(5)A与D可以形成原子个数比分别为2:1,1:1的两种化合物X和Y,其中 Y含有__________键(填“极性键”“非极性键”),A与C组成的两种化合物M和N所含的电子数分别与X、Y相等, N的结构式为__________。
(6)E的氢化物的价层电子对互斥理论模型为 _______,E 原子的杂化方式为 ________杂化。
(7)F单质的晶体在不同温度下有两种堆积方式,晶胞分别如右图所示。面心立方晶胞和体心立方晶胞的棱边长分别为acm、bcm,则F单质的面心立方晶胞和体心立方晶胞的密度之比为____________,F原子配位数之比为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将1.000 mol·L-1盐酸滴入20.00 mL 1.000 mol·L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示。下列有关说法正确的是( )

A. a点由水电离出的c(H+)=1.0×10-14 mol·L-1
B. b点:c(NH![]() )+c(NH3·H2O)=c(Cl-)
)+c(NH3·H2O)=c(Cl-)
C. c点:c(Cl-)=c(NH![]() )
)
D. d点后,溶液温度略下降的主要原因是NH3·H2O电离吸热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有H+、Mg2+、NH4+、Al3+、Fe3+、CO32—、SO42—、Cl—中的几种。若加入锌粒,产生无色无味的气体;若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。则下列说法不正确的是
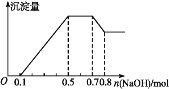
A. 溶液中的阳离子有H+、Mg2+、NH4+、Al3+
B. 溶液中n(Al3+)=0.1 mol
C. 溶液中一定不含CO32—,可能含有SO42—和Cl—
D. n(H+)∶n(Al3+)∶n(Mg2+)=1∶1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】湖北随州安陆等地区盛产银杏,银杏叶具有敛肺平喘、活血化淤、止痛的作用,是一种珍贵的中药材。对银杏叶活性成分黄酮类物质的提取常用的技术有溶剂提取法、蒸馏法、升华法、结晶法、超声波提取法等。下列关于分离提纯实验仪器和操作正确的是
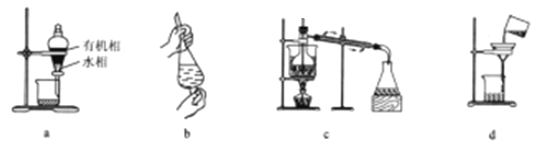
A. 用装置a分液,放出水相后再从分液漏斗下口放出有机相
B. 操作b:银杏油粗产品从银杏叶中分离后,用有机溶剂萃取其中的有效成分,振荡过程中不时地旋开活塞使漏斗内气体放出
C. 用装置c进行蒸馏操作,将有机溶剂分离出去得到银杏叶有效成分黄酮类物质
D. 结晶后利用装置d将晶体与溶剂分离开
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从实验测得不同物质中氧氧之间的键长和键能的数据:
O—O键 数据 | O | O | O2 | O |
键长(10-12 m) | 149 | 128 | 121 | 112 |
键能(kJ·mol-1) | x | y | z=494 | w=628 |
其中x、y的键能数据尚未测定,但可根据规律性推导键能的大小顺序为w>z>y>x;该规律性是
A.成键的电子数越多,键能越大
B.键长越长,键能越小
C.成键所用的电子数越少,键能越大
D.成键时电子对越偏移,键能越大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
①江河入海口三角洲的形成通常与胶体的性质有关
②“钡餐”中使用的硫酸钡是弱电解质
③冰和干冰既是纯净物又是化合物
④雾是气溶胶,在阳光下可观察到丁达尔现象
⑤某无色溶液中加入稀盐酸,产生的气体可使澄清石灰水变浑浊,则原溶液中一定含CO![]()
⑥可用渗析法分离Fe(OH)3胶体和KCl溶液
A. ①③④⑤ B. ①③④⑥ C. ①③④⑤⑥ D. ①②③④⑤⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com