
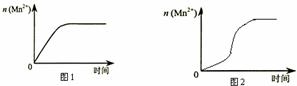 某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
| 0.6 mol/L H2C2O4溶液 | H2O | 0.2mol/L KMnO4溶液 | 3 mol/L 稀H2SO4 | ||
| 1 | 3.0 | 2.0 | 3.0 | 2.0 | 4.0 |
| 2 | 3.0 | V1 | 2.0 | 2.0 | 5.2 |
| 3 | 3.0 | 4.0 | V2 | ||
| 实验 编号 | 室温下,试管中所加试剂及其用量/mL | 在向试管中加 入少量固体 | 室 温 下溶液颜 色 褪 至 无 色 所 需时间/min | |||
| 0.6mol/L H2C2O4 溶液 | H2O | 0.2mol/L KMnO4 溶液 | mol/L 稀 硫酸 | |||
| 4 | 3.0 | 2.0 | 2.0 | t | ||
分析 (1)溶液的总体积相同,硫酸和草酸的浓度相同,用量也相同,通过改变高锰酸钾的量来改变高锰酸钾的浓度,再根据高锰酸钾溶液溶液浓度不同对反应速率的影响进行解答;
(2)先根据醋酸和高锰酸钾的物质的量判断过量,然后根据不足量及反应速率表达式计算出反应速率;
(3)①由图乙可知反应开始后锰离子浓度增大,反应速率增加的比较快,所以探究的是硫酸镁在反应中的作用;
②作对比实验时,除了加入MnSO4不同外,其它量完全相同,据此进行解答;
③若反应加快,说明Mn2+是催化剂,反应过程中溶液褪色时间减少.
解答 解:(1)溶液的总体积相同,硫酸和草酸的浓度相同,用量也相同,根据实验1可知溶液总体积为10mL,所以V1=3.0mL,V2=1.0mL,从表中数据可知改变的条件是KMnO4浓度;其他条件相同时,增大KMnO4浓度,反应速率增大,
故答案为:3.0mL;1.0mL;其他条件相同时,增大KMnO4浓度反应速率增大;
(2)草酸的物质的量为:0.6mol•L-1×0.003L=0.0018mol,高锰酸钾的物质的量为:0.2mol•L-1×0.003L=0.0006mol,草酸和高锰酸钾的物质的量之比为:0.0018mol:0.0006mol=3:1,显然草酸过量,高锰酸钾完全反应,混合后溶液中高锰酸钾的浓度为:$\frac{0.2mol/L×0.003L}{(3+2+3+2)×1{0}^{-3}L}$=0.06mol/L,
这段时间内平均反应速率v(KMnO4)=$\frac{0.06mol/L}{4min}$=1.5×10-2 mol/(L•min),
故答案为:1.5×10-2 mol/(L•min);
(3)①由图乙可知反应开始后速率增大的比较快,说明生成物中的MnSO4(或Mn2+)为该反应的催化剂,
故答案为:生成物中的MnSO4为该反应的催化剂(或Mn2+对该反应有催化作用);
②与实验1作对比实验,除要加入硫酸锰不同外,其它条件必须相同,所以加入的高锰酸钾的量为3.0mL,少量固体为MnSO4,
故答案为:
| 实验 编号 | 室温下,试管中所加试剂及其用量/mL | 在向试管中加 入少量固体 | 室 温 下溶液颜 色 褪 至 无 色 所 需时间/min | |||
| 0.6mol/L H2C2O4 溶液 | H2O | 0.2mol/L KMnO4 溶液 | mol/L 稀 硫酸 | |||
| 3.0 | MnSO4 | |||||
点评 本题主要结合实验考查了影响化学反应速率的因素,题目难度中等,注意掌握温度、催化剂对化学反应速率的影响,解题关键是对比分析图表中的数据找出相同点和不同点,然后得出合理结论,试题培养了学生的分析能力及化学实验能力.


科目:高中化学 来源: 题型:选择题
| A. | 丙烯分子中3个碳原子都是sp3杂化 | |
| B. | 每个丙烯分子有7个σ键,1个π键 | |
| C. | 丙烯分子是存在非极性键和极性键的极性分子 | |
| D. | 丙烯分子为手性分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
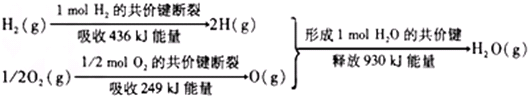
| A. | 氢气跟氧气反应生成水的同时释放能量 | |
| B. | 氢气跟氧气反应生成水的同时吸收能量 | |
| C. | 1 mol H2跟1/2 mol O2反应生成1 mol H2O释放能量不一定是245 kJ | |
| D. | 2 mol H2(g)跟1 mol O2(g)反应生成2 mol H2O(g)释放能量490 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Ba2+、Cl-、SO42- | B. | H+、NH4+、Al3+、SO42- | ||
| C. | H+、Fe2+、NO3-、Cu2+ | D. | K+、AlO2-、CH3COO-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该离子反应配平后H2O的系数22 | |
| B. | MnO4-是氧化剂,既Cu2S是氧化剂又是还原剂 | |
| C. | 氧化性:MnO4-<Cu2+ | |
| D. | 生成2.24L(标况下)SO2时反应中转移电子的物质的量是0.6 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 取样品mg,配成100ml溶液,取25.00mL于锥形瓶中,滴加几滴石蕊试液,用浓度为cmol/L的标准盐酸滴定至终点时,消耗盐酸Vml | |
| B. | 取样品mg,充分加热,冷却,称量固体的质量为n1g | |
| C. | 取样品mg,滴加足量的BaCl2溶液,过滤,洗涤,于燥后称量固体的质量为n2g | |
| D. | 取样品mg,滴加足量的Ba(OH)2过滤,洗涤,干燥后称量固体的质量为n3g |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com