
【题目】X、Y、Z是三种短周期的主族元素,在周期表的位置如图,X原子的最外层电子数是其次外层电子数的3倍,下列说法正确的是( )
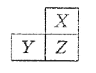
A.原子半径: Y >Z >X
B.元素气态氢化物的热稳定性:X < Z
C.Y和Z的最高价氧化物对应水化物均为强酸
D.X的最高正价为+6
【答案】A
【解析】
X、Y、Z是三种短周期的主族元素,由各元素在周期表中的位置可知,X处于第二周期,Y、Z处于第三周期,由X原子的最外层电子数是其次外层电子数的3倍可知, X为O元素,由各元素在周期表中的位置可知,Z为S元素、Y为P元素。
A.同周期元素,从左到右原子半径依次减小,所以原子半Y>Z,同主族元素,自上而下原子半径依次增大,所以原子半径Z>X,则原子半径Y>Z>X,故A正确;
B.同主族元素,自上而下非金属性依次减弱,所以非金属性X>Z,非金属性越强,氢化物越稳定,所以气态氢化物的热稳定性X>Z,故B错误;
C.硫元素的最高价氧化物对应水化物硫酸是强酸,磷元素的最高价氧化物对应水化物磷酸是中强酸,故C错误;
D.硫元素的最高正价为+6价,氧元素一般没有正化合价,故D错误;
故选A。


科目:高中化学 来源: 题型:
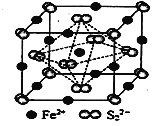
【题目】铁及其化合物有重要且广泛的应用
(1)基态Fe2+的价层电子的轨道表示式为_____________
(2)检验Fe3+可以用KSCN溶液,写出SCN-的一种等电子体分子_______。
(3)部分电离能数据如下表:
元素 | Mn | Fe | |
电离能(kJ/mol) |
| 717 | 759 |
| 1 509 | 1 561 | |
| 3 248 | 2 957 | |
根据表中数据可知,气态Mn2+ 再失去一个电子比气态Fe2+ 再失去一个电子难,其原因是_______________________________________________________
(4)过渡金属原子可以与CO分子形成配合物,配合物价电子总数符合“18电子规则”。如Cr可以与CO形成Cr(CO)6 分子:价电子总数(18)= Cr的价电子数(6)+CO提供电子数(2×6).Fe原子也能与CO形成配合物,其化学式为________.
(5)FeS2晶体的晶胞如图所示。晶胞边长为a nm、FeS2相对式量为M,阿伏加德罗常数的值为NA,其晶体密度的计算表达式为___________g·cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
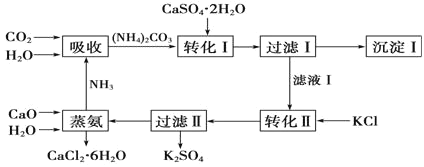
【题目】石膏转化为硫酸钾和CaCl2的工艺流程如图:
![]()
(1)CO2是一种很重要的副产品,工业上获得CO2的途径是___(用化学方程式表示)。
(2)过滤Ⅰ得到的滤液是___,检验滤液中含有CO32-的方法__。
(3)转化Ⅱ中发生反应的化学方程式为___,转化Ⅱ中可获得K2SO4的原因是__。
(4)氯化钙结晶水合物是目前常用的无机储热材料,选择的依据是___。
a.熔点较低(29℃熔化) b.能制冷
c.无毒 d.能导电
(5)废水中氨氮(主要以NH4+和NH3形式存在)的去除常见的有生物脱氮法和电解法。而电解法产生的强氧化物质HClO也可将氨氮转化为氮气而除去,实验室用石墨电极电解一定浓度的(NH4)2SO4与NaCl的酸性溶液来模拟。阳极的电极反应式___,处理1mol(NH4)2SO4,需要消耗HClO物质的量是___mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向浓度为0.1 molL-1、体积为V L的氨水中逐滴加入一定浓度的盐酸,用pH计测溶液的pH随盐酸的加入量而降低的滴定曲线,d点两种溶液恰好完全反应。根据图中信息回答下列问题:
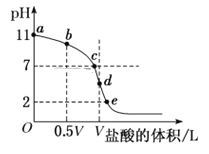
(1)该温度时NH3·H2O的电离常数K=________。
(2)滴定过程中所用盐酸的浓度________molL-1。
(3)比较b、c、d三点时的溶液中,水电离程度最大点为___________。(填字母)
(4)滴定时,由b点到c点的过程中,下列各选项中数值变大的是___(填字母,下同)。
A. c(H+)/c(OH-) B.c(H+)·c(NH3·H2O)/c(NH4+)
C.c(NH4+)·c(OH-)/c(NH3·H2O) D.c(H+)·c(OH-)
(5)根据以上滴定曲线判断下列说法正确的是______(溶液中N元素只存在NH4+和NH3·H2O两种形式)。
A.点b所示溶液中:c(NH4+)+c(H+)=c(OH-)+c(NH3·H2O)
B.点c所示溶液中:c(Cl-)=c(NH3·H2O)+c(NH4+)
C.点d所示溶液中:c(Cl-)>c(H+)>c(NH4+)>c(OH-)
D.滴定过程中可能有:c(NH3·H2O)>c(NH4+)>c(OH-)>c(Cl-)>c(H+)
(6)d点之后若继续加入盐酸至图像中的e点(不考虑NH4+水解的影响),则e点对应的横坐标为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在如图所示的装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体d呈喷泉状喷出,最终几乎充满烧瓶。则a和b分别是
a(干燥气体) | b(液体) |
| |
A | NO | 水 | |
B | CO2 | 饱和NaHCO3溶液 | |
C | Cl2 | 饱和NaCl溶液 | |
D | NH3 | 1 mol·L-1盐酸 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将![]() mL 1mo/L
mL 1mo/L ![]() 和
和![]() mL 1mo/L
mL 1mo/L ![]() 两种酸溶液分别加水稀释,稀释溶液体积为V,稀释液pH与其体积变化的关系如图所示。下列说法正确的是
两种酸溶液分别加水稀释,稀释溶液体积为V,稀释液pH与其体积变化的关系如图所示。下列说法正确的是
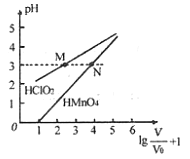
A. ![]() 和
和![]() 均为一元弱酸
均为一元弱酸
B. 在0≤pH≤5时,![]() 溶液满足
溶液满足![]()
C. 分别往M、N两点对应溶液中滴加1 mo/L NaOH溶液至恰好完全反应,消耗NaOH溶液的体积相等
D. 常温下,浓度均为0.1 mo/L的![]() 和
和![]() 溶液,溶液pH:
溶液,溶液pH:![]() >
>![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某微生物电解池(MEC)制氢工作原理如右图所示。用该电解池电解0.1mol·L-1的CH3COOH溶液,下列说法正确的是
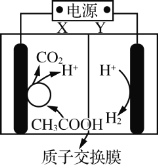
A.Y为电源的正极
B.该电解装置中,阳极的电极反应式为:CH3COOH+2H2O+8e-= 2CO2↑+8H+
C.当2mol H+通过质子交换膜时,则标准状况下产生22.4L H2
D.电解一段时间后,溶液中![]() 的值变小
的值变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应2SO2+ O2![]() 2SO3达到平衡的标志是
2SO3达到平衡的标志是
①消耗2 mol SO2的同时生成2 mol SO3
② SO2、O2与SO3的物质的量之比为2∶1∶2
③反应混合物中,SO3的质量分数不再改变
A.①②B.①③C.只有③D.只有①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知:CH4(g)+2H2S(g)![]() CS2(g)+4H2(g)。向恒容密闭容器中充入0.lmolCH4和0.2molH2S,如图所示:
CS2(g)+4H2(g)。向恒容密闭容器中充入0.lmolCH4和0.2molH2S,如图所示:
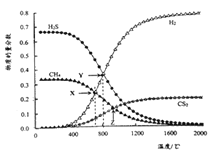
下列说法不正确的是
A.该反应的△H>0
B.X点CH4的转化率为20%
C.X点与Y点容器内压强比为55:51
D.维持Z点温度,向容器中再充入CH4、H2S、CS2、H2各0.1mol时v(正)<v(逆)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com