
[化学——有机化学基础](13分)
香豆素是一种重要香料,以下是两种常见香豆素。
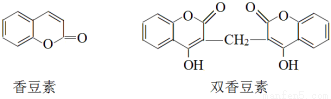
(1)关于香豆素和双香豆素,下列说法正确的是 (填序号)。
A.分子中均含有酯基
B.都属于芳香族化合物
C.双香豆素不能使溴水褪色
D.1 mol香豆素含C=C数为4NA(NA为阿伏加德罗常数的值)
(2)写出香豆素与足量NaOH溶液反应的化学方程式 。
(3)以甲苯为原料生产香豆素流程如下:

已知:(ⅰ)B可与FeCl3溶液发生显色反应;
(ⅱ)同一个碳原子上连两个羟基通常不稳定,易脱水形成羰基。
①C的结构简式是 。
②B→C的反应类型是 。
③ 与乙酸酐(
与乙酸酐(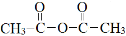 )反应,除生成
)反应,除生成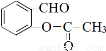 外,另一种产物是 。
外,另一种产物是 。
④异香豆素与香豆素互为同分异构体,具有以下特点:(a)含有苯环;(b)含有与香豆素相似的两个六元环;(c)1 mol异香豆素与足量NaOH溶液反应时消耗1 mol NaOH。写出异香豆素的结构简式 。
(1)AB(2分) (2)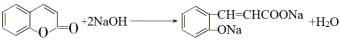 (3分)
(3分)
(3)①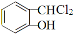 (2分) ②取代反应(2分) ③CH3COOH或乙酸(2分) ④
(2分) ②取代反应(2分) ③CH3COOH或乙酸(2分) ④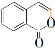 (2分)
(2分)
【解析】
试题分析:(1)A、分子中均含有酯基,A正确;B、分子中均含有苯环,都属于芳香族化合物,B正确;C、双香豆素中也含有碳碳双键,能使溴水褪色,C不正确;D、苯环中不存在碳碳双键,因此1 mol香豆素含C=C数为NA(NA为阿伏加德罗常数的值),D不正确,答案选AB。
(2)香豆素中的酯基水解后产生酚羟基,酚羟基与氢氧化钠反应,因此香豆素与足量NaOH溶液反应的化学方程式为 。
。
(3)根据香豆素的结构简式以及B可与FeCl3溶液发生显色反应可知,甲苯与氯气发生的是甲基邻位上的氢原子被取代,因此A的结构简式为 。A生成B是氯原子被羟基取代,则B的结构简式为
。A生成B是氯原子被羟基取代,则B的结构简式为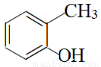 。根据C的分子式可知,B生成C应该是甲基上的2个氢原子被氯原子代替,则C的结构简式为
。根据C的分子式可知,B生成C应该是甲基上的2个氢原子被氯原子代替,则C的结构简式为 。由于同一个碳原子上连两个羟基通常不稳定,易脱水形成羰基,因此C通过水解反应转化为邻羟基苯甲醛。邻羟基苯甲醛与乙酸酐通过取代反应生成
。由于同一个碳原子上连两个羟基通常不稳定,易脱水形成羰基,因此C通过水解反应转化为邻羟基苯甲醛。邻羟基苯甲醛与乙酸酐通过取代反应生成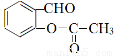 。最后在催化剂的作用下
。最后在催化剂的作用下 发生分子内的加成反应生成香豆素。
发生分子内的加成反应生成香豆素。
①根据以上分析可知C的结构简式是 。
。
②B→C的反应类型是取代反应。
③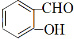 与乙酸酐(
与乙酸酐( )反应,除生成
)反应,除生成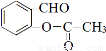 外,根据原子守恒可知另一种产物是CH3COOH。
外,根据原子守恒可知另一种产物是CH3COOH。
④含有苯环;含有与香豆素相似的两个六元环;1 mol异香豆素与足量NaOH溶液反应时消耗1 mol NaOH,这说明酯基水解后产生的羟基不是酚羟基,因此异香豆素的结构简式为 。
。
考点:考查有机物推断、性质、有机反应类型、同分异构体判断以及方程式书写等


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2013-2014福建省福州八县第二学期期中考试高一化学试卷(解析版) 题型:选择题
用铁片与稀硫酸反应制取氢气时,下列措施不能使反应速率加快的是( )
A.加热 B.用98%的浓硫酸代替稀硫酸
C.滴加少量硫酸铜溶液 D.若用铁片改用铁粉
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省漳州市八校高三第四次联考理综化学试卷(解析版) 题型:选择题
NA表示阿伏加德罗常数的数值,下列说法正确的是
A.用石墨电极电解Ca(NO3)2溶液,当转移电子数为0.2 NA时,阴极析出4 g金属
B.0.1 mol24Mg32S晶体中所含中子总数为2.8 NA
C.常温下含有NA个NO2、N2O4分子的混合气体,温度降至标准状况,其体积约为22.4 L
D.在熔融状态下,1 mol NaHSO4完全电离出的阳离子数目为2 NA
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省高二下学期期末考试化学试卷(解析版) 题型:选择题
反应X(g)+Y(g) 2Z(g); ΔH<0,达到平衡时,下列说法正确的是
2Z(g); ΔH<0,达到平衡时,下列说法正确的是
A.减小容器体积,平衡向右移动 B.加入催化剂,Z的产率增大
C.增大c(X),X的转化率增大 D.降低温度,Y的转化率增大
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省高二下学期期末考试化学试卷(解析版) 题型:选择题
一种充电电池放电时的电极反应为H2+2OH—2e-=2H2O;NiO(OH)+H2O+e-=Ni(OH)2+OH-,当为电池充电时,与外电源正极连接的电极上发生的反应是
A. H2O的还原 B. NiO(OH)的还原 C. H2的氧化 D. NiO(OH) 2的氧化
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省宁德市高三5月质检理综化学试卷(解析版) 题型:选择题
常温下,取pH=2的 HA溶液与HB溶液各1 mL,分别加水稀释,测得pH变化与稀释倍数关系如图所示。下列叙述正确的是
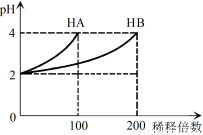
A.HB的电离方程式为HB=H++B-
B.稀释前,c(HB) > c(HA)=0.01 mol·L-1
C.NaA的水溶液中,离子浓度大小为c(Na+)>c(A-)>c(OH-)>c(H+)
D.NaA、NaB的混合溶液中:2c(Na+)=c(A-)+c(B-)+c(HB)
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省四地六校高三高考模拟试理综化学试卷(解析版) 题型:填空题
【选修3:物质结构与性质】(10分)
血红素中含有C、O、N、Fe五种元素。回答下列问题:
(1)C、N、O、H四种元素中电负性最小的是 (填元素符合),写出基态Fe原子的核外电子排布式 。
(2)下图所示为血红蛋白和肌红蛋白的活性部分――血红素的结构式。血红素中N原子的杂化方式有 ,在右图的方框内用“→”标出Fe2+的配位键。
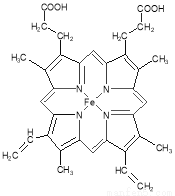
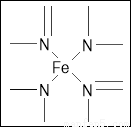
(3)NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69 pm和78 pm,则熔点NiO ________ FeO(填“<”或“>”);
(4)N与H形成的化合物肼(N2H4)可用作火箭燃料,燃烧时发生的反应是:
2N2H4(l)+ N2O4(l)=3N2(g)+ 4H2O(g) △H=-1038.7kJ/mol
若该反应中有4mol N—H键断裂,则形成的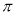 键有___________mol。
键有___________mol。
(5)根据等电子原理,写出CN—的电子式 ,1 mol O22+中含有的π键数目为 。
(6)铁有δ、γ、α三种同素异形体如下图所示。则γ晶体晶胞中所含有的铁原子数为 ,δ、α两种晶胞中铁原子的配位数之比为 。
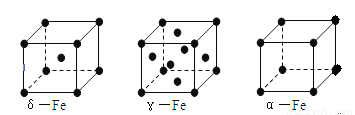
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省高三热身考试化学试卷(解析版) 题型:选择题
25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq)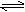 Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如下图所示。下列判断正确的是
Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如下图所示。下列判断正确的是

A.往平衡体系中加入金属铅后,c(Pb2+)增大
B.往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小
C.升高温度,平衡体系中c(Pb2+)增大,说明该反应⊿H>0
D.25℃时,该反应的平衡常数K=2.2
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省高一下学期期末考试化学试卷(解析版) 题型:实验题
乙酸乙酯是无色具有水果香味的液体,沸点为77.2 ℃,实验室某次制取它用冰醋酸14.3 mL、95%乙醇 23 mL。还用到浓硫酸、饱和碳酸钠以及极易与乙醇结合成六水合物的氯化钙溶液。主要装置如图所示:

实验步骤:
①先向A中的蒸馏烧瓶中注入少量乙醇和浓硫酸后摇匀,再将剩下的所有乙醇和冰醋酸注入分液漏斗里待用。这时分液漏斗里冰醋酸和乙醇的物质的量之比约为5∶7。
②加热油浴保温约135 ℃~145℃
③将分液漏斗中的液体缓缓滴入蒸馏烧瓶里,调节加入速率使蒸出酯的速率与进料速率大体相等,直到加料完成。
④保持油浴温度一段时间,至不再有液体馏出后,停止加热。
⑤取下B中的锥形瓶,将一定量饱和Na2CO3溶液分批少量多次地加到馏出液里,边加边振荡,至无气泡产生为止。
⑥将⑤的液体混合物分液,弃去水层。
⑦将饱和CaCl2溶液(适量)加入到分液漏斗中,振荡一段时间后静置,放出水层(废液)。
⑧分液漏斗里得到的是初步提纯的乙酸乙酯粗品。
试回答:
(1)实验中浓硫酸的主要作用是__________ _______。
(2)用过量乙醇的主要目的是________ _________。
(3)用饱和Na2CO3溶液洗涤粗酯的目的是________ ___。
如果用NaOH溶液代替Na2CO3溶液将引起的后果___________________________________。
(4)用饱和CaCl2溶液洗涤粗酯的目的是_____ ______。
(5)在步骤⑧所得的粗酯里还含有的杂质是______ ___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com