
【选修3:物质结构与性质】(10分)
血红素中含有C、O、N、Fe五种元素。回答下列问题:
(1)C、N、O、H四种元素中电负性最小的是 (填元素符合),写出基态Fe原子的核外电子排布式 。
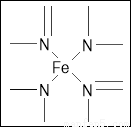
(2)下图所示为血红蛋白和肌红蛋白的活性部分――血红素的结构式。血红素中N原子的杂化方式有 ,在右图的方框内用“→”标出Fe2+的配位键。
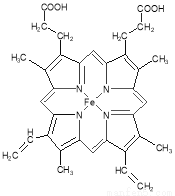
(3)NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69 pm和78 pm,则熔点NiO ________ FeO(填“<”或“>”);
(4)N与H形成的化合物肼(N2H4)可用作火箭燃料,燃烧时发生的反应是:
2N2H4(l)+ N2O4(l)=3N2(g)+ 4H2O(g) △H=-1038.7kJ/mol
若该反应中有4mol N—H键断裂,则形成的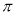 键有___________mol。
键有___________mol。
(5)根据等电子原理,写出CN—的电子式 ,1 mol O22+中含有的π键数目为 。
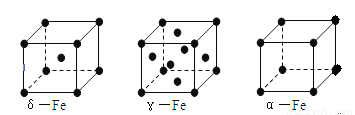
(6)铁有δ、γ、α三种同素异形体如下图所示。则γ晶体晶胞中所含有的铁原子数为 ,δ、α两种晶胞中铁原子的配位数之比为 。
(1)H;[Ar]3d64S2 (2)sp2、sp3;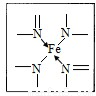 (3)> (4)3
(3)> (4)3
(5)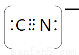 ;2NA (6)4;4:3
;2NA (6)4;4:3
【解析】
试题分析:(1)同周期元素从左到右元素的电负性逐渐增大,则有电负性C<N<O,H的电负性最小。铁的原子序数是26,根据核外电子排布规律可知,基态Fe原子的核外价电子排布式为[Ar]3d64S2。(2)形成双键的N原子空间构型为平面,所以为sp2杂化,形成单键的N原子,与NH3杂化相同,可知应该是sp3杂化;N原子最外层有5个电子,只需要形成3条键即可达到稳定结构,但是图中形成双键的N原子形成了四条键,显然有一条为配位键,可表示为 。
。
(3)NiO、FeO的晶体结构类型均与氯化钠的相同,说明二者都是离子晶体,离子晶体的熔点与离子键的强弱有关,离子所带电荷数越多,离子半径越小,离子键越强,熔点越高.由于Ni2+的离子半径小于Fe2+的离子半径,属于熔点是NiO>FeO。
(4)N2H4中含有4个N-H单键,根据化学方程式可知,若反应中有4mol N—H键断裂,则必然生成1.5mol氮气。氮气中含有氮氮三键。而三键含有1个σ键和2个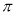 键,因此反应中形成的
键,因此反应中形成的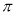 键有1.5mol×2=3mol。
键有1.5mol×2=3mol。
(5)价电子数与原子数分别都相等的是等电子体,CN-与氮气互为等电子体,则根据氮气分子的电子式写出CN-的电子式,且CN-是离子,符合离子电子式的书写规则,所以其电子式为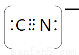 ;O22+与氮气也互为等电子体,则1 mol O22+中含有的π键数目为2NA。
;O22+与氮气也互为等电子体,则1 mol O22+中含有的π键数目为2NA。
(6)γ晶体晶胞中所含有的铁原子数为8×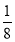 +6×
+6×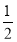 =4,δ、α两种晶胞中铁原子的配位数分别为8、6,则配位数之比为8:6=4:3。
=4,δ、α两种晶胞中铁原子的配位数分别为8、6,则配位数之比为8:6=4:3。
考点:考查元素电负性、原子核外电子排布、空间构型;晶胞的计算、原子轨道杂化方式及杂化类型判断


科目:高中化学 来源:2013-2014福建省高二下学期期末考试化学试卷(解析版) 题型:选择题
用惰性电极电解一定浓度的硫酸铜溶液,长时间通电后,向所得溶液中加入0.2mol Cu(OH)2,恰好恢复到电解前的浓度和pH。则电解过程中转移电子的总物质的量为
A.0.2mol B.0.4mol C.0.6mol D.0.8mol
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省宁德市高三5月质检理综化学试卷(解析版) 题型:推断题
[化学——有机化学基础](13分)
香豆素是一种重要香料,以下是两种常见香豆素。
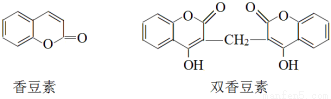
(1)关于香豆素和双香豆素,下列说法正确的是 (填序号)。
A.分子中均含有酯基
B.都属于芳香族化合物
C.双香豆素不能使溴水褪色
D.1 mol香豆素含C=C数为4NA(NA为阿伏加德罗常数的值)
(2)写出香豆素与足量NaOH溶液反应的化学方程式 。
(3)以甲苯为原料生产香豆素流程如下:

已知:(ⅰ)B可与FeCl3溶液发生显色反应;
(ⅱ)同一个碳原子上连两个羟基通常不稳定,易脱水形成羰基。
①C的结构简式是 。
②B→C的反应类型是 。
③ 与乙酸酐(
与乙酸酐(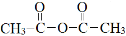 )反应,除生成
)反应,除生成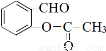 外,另一种产物是 。
外,另一种产物是 。
④异香豆素与香豆素互为同分异构体,具有以下特点:(a)含有苯环;(b)含有与香豆素相似的两个六元环;(c)1 mol异香豆素与足量NaOH溶液反应时消耗1 mol NaOH。写出异香豆素的结构简式 。
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省宁德市高三5月质检理综化学试卷(解析版) 题型:选择题
A、B、C、D均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去)。则A不可能是

A.金属单质 B.非金属单质 C.两性氧化物 D.碱
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省四地六校高三高考模拟试理综化学试卷(解析版) 题型:选择题
用酸性氢氧燃料电池为电源进行电解的实验装置如下图所示。下列说法正确的是( )

A.燃料电池工作时,正极反应为:O2 + 2H2O + 4e- === 4OH-
B.若a极是铁,b极是铜时,b极逐渐溶解,a极上有铜析出
C.若a、b极都是石墨,在相同条件下a极产生的气体与电池中消耗的H2体积相等
D.若a极是粗铜,b极是纯铜时,a极逐渐溶解,b极上有铜析出
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省高三热身考试化学试卷(解析版) 题型:填空题
[物质结构与性质,13分]
(1)与铜同周期、基态原子最外层电子数相同的过渡元素,其基态原子的电子排布式 。
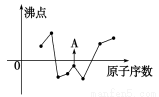
(2)下图曲线表示部分短周期元素的原子序数(按递增顺序排列)和其常见单质沸点的关系。其中A点表示的单质是 (填化学式)。
键长/(pm) | B—F | B—Cl | B—Br |
计算值 | 152 | 187 | 199 |
实测值 | 130 | 175 | 187 |
(3)三氟化硼分子的空间构型是 ;三溴化硼、三氯化硼分子结构与三氟化硼相似,如果把B-X键都当作单键考虑来计算键长,理论值与实测键长结果如右表。硼卤键长实测值比计算值要短得多,可能的原因是 。
(4)海产品添加剂多聚磷酸钠是由Na+与多聚磷酸根离子组成的,某种多聚磷酸根的结构如图。
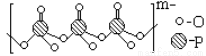
①磷原子的杂化类型为 。
②这种多聚磷酸钠的化学式为 。
(5)已知HF与F-通过氢键结合成HF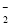 。判断HF
。判断HF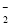 和HF
和HF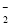 微粒间能否形成氢键,并说明理由。
微粒间能否形成氢键,并说明理由。
。
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省南平市毕业班质量检查理综化学试卷(解析版) 题型:选择题
如图所示甲、乙两个装置,所盛溶液体积和浓度均相同且足量,当电路中通过的电子都是0.1mol时,下列说法正确的是( )

A.相同条件下产生气体的体积:V甲=V乙
B.溶液pH值变化:甲减小乙增大
C.溶液的质量变化:甲减小乙增大
D.电极反应式:甲中阴极:Cu2++2e—= Cu, 乙中负极:Mg - 2e—= Mg2+
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省高一下学期期末考试化学试卷(解析版) 题型:选择题
下列用水就能鉴别的一组物质是( )
A.苯、己烷、四氯化碳 B.苯、乙醇、四氯化碳
C.苯、乙醇、乙酸乙酯 D.硝基苯、乙醇、乙酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com